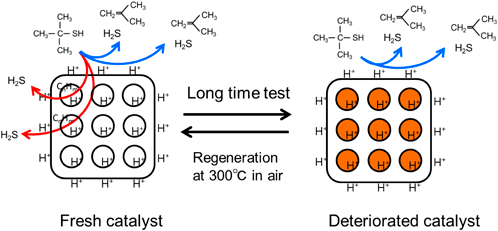
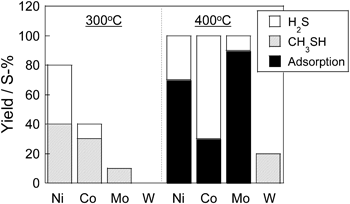
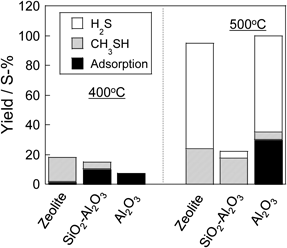
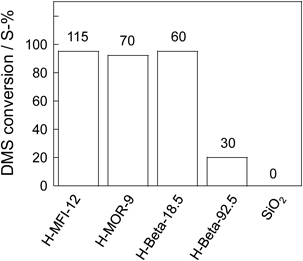
ゼオライトの酸性質を利用した有機硫黄化合物の直接分解Direct Decomposition of Organic Sulfur Compounds Using Acid Properties of Zeolite
1 九州大学大学院工学研究院化学工学部門Department of Chemical Engineering, Faculty of Engineering, Kyushu University ◇ 〒819–0395 福岡市西区元岡744
2 成蹊大学理工学部理工学科Department of Applied Chemistry, Faculty of Science and Engineering, Seikei University ◇ 〒180–8633 武蔵野市吉祥寺北町3–3–1