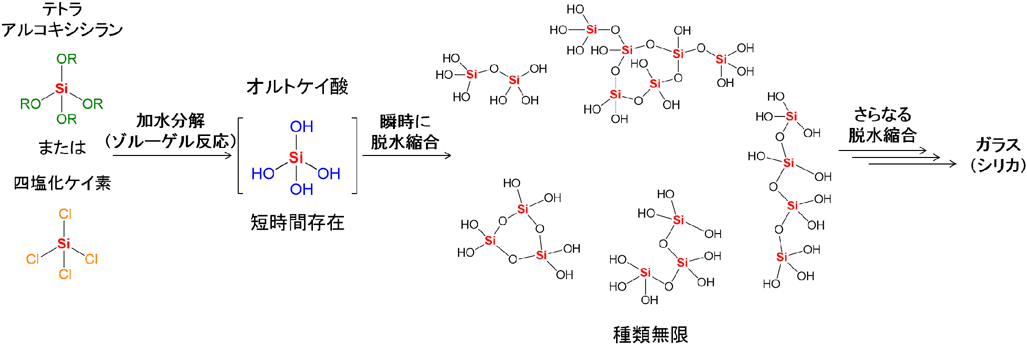
ゼオライトやガラスに代表される無機ケイ素化合物だけでなく,シリコーンなどの有機ケイ素化合物の基本単位であるオルトケイ酸(Si(OH)4)は,テトラアルコキシシラン(Si(OR)4)や四塩化ケイ素(SiCl4)の加水分解の際に短時間だけ発生し,次の反応を起こす「真の前駆体」である1)。これまでにない機能や高い性能を持つケイ素材料を製造するために,オルトケイ酸の安定な合成と単離が求められてきた。
また,自然界には石などから溶出したごく低濃度のオルトケイ酸が存在する(海水中の平均濃度0.00673 g/l)2)。植物(特にイネ科)は,天然に存在するオルトケイ酸を吸収し,もみ殻や茎,葉などにシリカを蓄積させて物理的に丈夫になるだけでなく,害虫や病原菌を防いでいる3)。また,天然水や麦(イネ科)から作られる飲料など(ビールなど)にはオルトケイ酸が溶け込んでおり,動物の骨や髪,皮膚,爪などの体組織の一部の原料となっている4–6)。動植物がオルトケイ酸を取り込み,利用するメカニズムの詳細を明らかにするためにも,オルトケイ酸の分子構造の解明が求められてきた。
19世紀前半にBerzelius, J. J.によりシリカが水に溶ける現象が発見され,溶解性のシリカ(オルトケイ酸)の化学がスタートした7)。また,Friedel, C.とCrafts, J. M.らも19世紀中頃にアルコキシシランの加水分解を行い,オルトケイ酸の重合物の存在について言及している8)。しかし,オルトケイ酸は速やかに縮合してしまうことから,当時は現象を観測するのみであり,オルトケイ酸の存在すら不明であった。その後も,組成や分子構造が不明な時代が長く続くこととなる。実験的に組成がSiO4H4であることが明らかにされ,さらに,ケイ素上に4つの水酸基(–OH)が結合した分子構造(Si(OH)4)であることが確認されるのは20世紀初頭から中頃にかけてである9–10)。しかし,オルトケイ酸は不安定で単離できないため,その詳細な構造は不明のまま,理論計算による分子構造の推測が行われてきた。
オルトケイ酸(Si(OH)4)は,テトラアルコキシシラン(Si(OR)4)や四塩化ケイ素(SiCl4)の加水分解によって生成するが11),速やかに脱水縮合してしまい,最終的にはシリカ(SiO2)になるため単離例は皆無である(図1)。
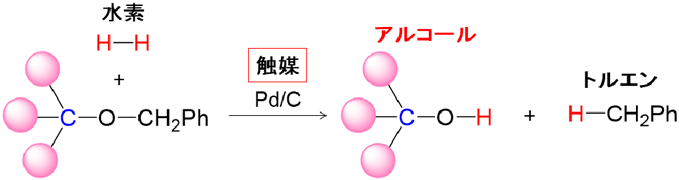
我々は,オルトケイ酸が不安定で単離できないのは,加水分解の際の水が,その後の脱水縮合に大きく影響しているという作業仮説を立て,水を使わないオルトケイ酸の合成反応の開発を検討した。そこで参考にしたのが,有機合成において用いられるベンジル基(Bn=CH2Ph)の脱保護によるアルコールの合成反応である。この反応では,ベンジル保護した基質をパラジウム炭素触媒存在下,水素と反応させることで,酸素–炭素結合に水素が付加し,アルコールとトルエンが生成する(図2)。
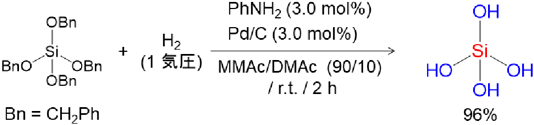
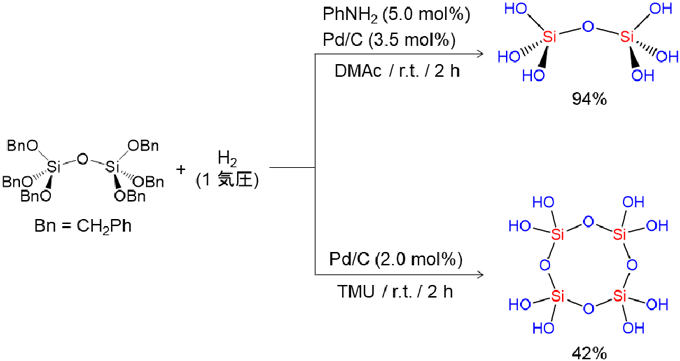
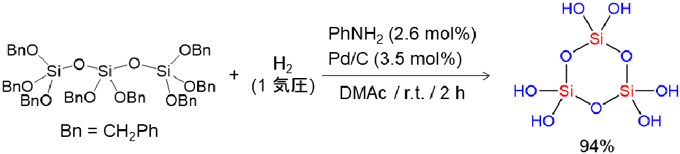
ケイ素は周期表で炭素の1つ下に位置する元素なので,同様の反応が進行すると考え,ケイ素にベンジルオキシ基を有する前駆体を合成し,水素化分解反応を検討した。種々反応条件を探索し,最適な触媒,反応溶媒,添加剤を見出すことができた。ベンジルオキシ基を4つ有するテトラベンジルオキシシランを,N–メチルアセトアミド(MMAc)とN,N–ジメチルアセトアミド(DMAc)の混合溶媒においてパラジウムカーボン触媒(Pd/C)存在下,少量のアニリンを添加して水素化分解する手法を開発することで,オルトケイ酸を収率良く(96%)合成することに成功した(図3)12)。
重水素を用いて同様の反応を行うと,重水素化されたオルトケイ酸(Si(OD)4)がほぼ定量的に得られることから,加水分解ではなく,確かに水素化分解により生成していることを確認した。
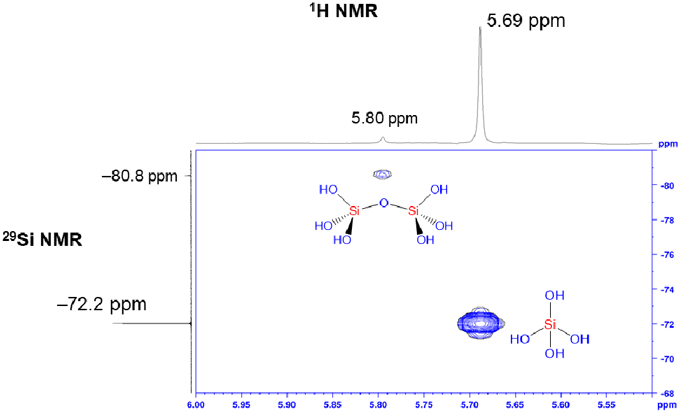
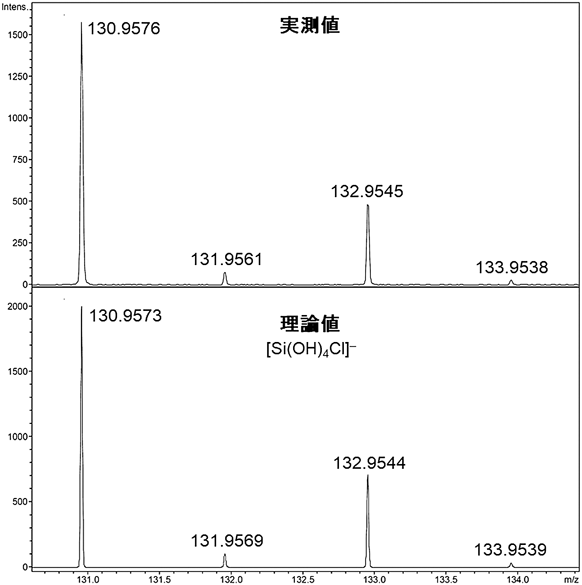
反応混合物の29Si NMRではオルトケイ酸を−72.2 ppmに,2量体を−80.8 ppmに観測した。特筆すべきことに,1H NMRにおいてオルトケイ酸の4つのOHのプロトンを5.69 ppmに,2量体の6つのOHのプロトンを5.80 ppmに観測することができた(図4)。加水分解反応で合成した場合,系中に水が存在しているため,水とオルトケイ酸の間でプロトン交換が起こってしまうことからオルトケイ酸のプロトンのシグナルを観測することができないが,我々の合成法では水が存在しないことからそのようなプロトン交換反応が起こらず,観測することが可能である。1H–29Si二次元NMRにおいても相関が観測され,オルトケイ酸のプロトンであることを確認した(図4)。続いて,高分解能質量分析(ESI-TOF)を測定した。オルトケイ酸に塩素イオンが付加したシグナル([Si(OH)4Cl]−=130.9576)が観測された。また,同位体パターンも理論値と完全に一致しており,質量分析からもオルトケイ酸であることを確認した(図5)。
得られたオルトケイ酸の安定性を評価するために,29Si NMRによる経時変化を追跡した。その結果,上述した加水分解による従来法では速やかに重合してしまうのに対し,今回開発した反応条件下では溶液中においても1週間後も10%程度しか減少(重合)しておらず,非常に安定であった。狙い通り,今回開発した無水条件による反応では,生成したオルトケイ酸は非常に安定に存在することが可能であった。
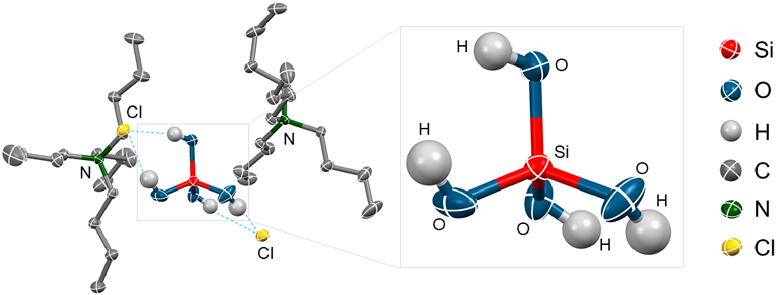
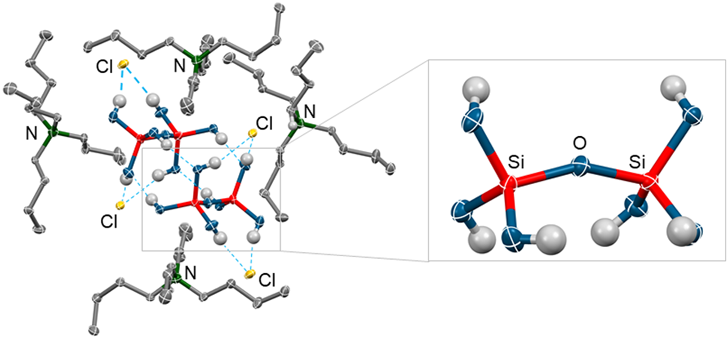
オルトケイ酸の詳細な分子構造を明らかにすることを目的とし,単結晶の作成を試みた。残念ながら,オルトケイ酸のみからなる単結晶を得ることはできなかった。結晶化を促進させるために,反応溶液にテトラブチルアンモニウム塩(nBu4NX, X=Cl, Br)を加えることで,1分子のオルトケイ酸と2分子のアンモニウム塩からなる単結晶を得ることができた。この単結晶の構造を明らかにするため,X線結晶構造解析を行った。X線結晶構造解析の結果,オルトケイ酸の2つのヒドロキシル基が1つの塩素イオンに対して水素結合した結晶構造であった(図6:破線)。オルトケイ酸の分子構造はほぼ理想的な正四面体構造をとっており,Si–O結合の平均結合長は1.6222 Åであり,O–Si–Oの平均結合角は109.76°であった(図6)。
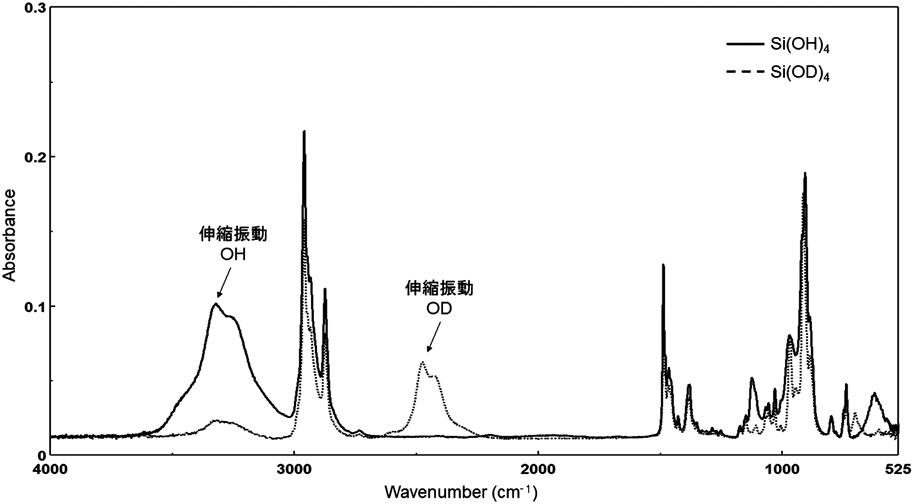
また,テトラブチルアンモニウム塩とSi(OH)4またはSi(OD)4との複合単結晶の赤外吸収スペクトルを測定したところ,対応するOHおよびODの伸縮振動を観測することができた(図7)。
5. オルトケイ酸の2量体と環状4量体の合成と構造解析
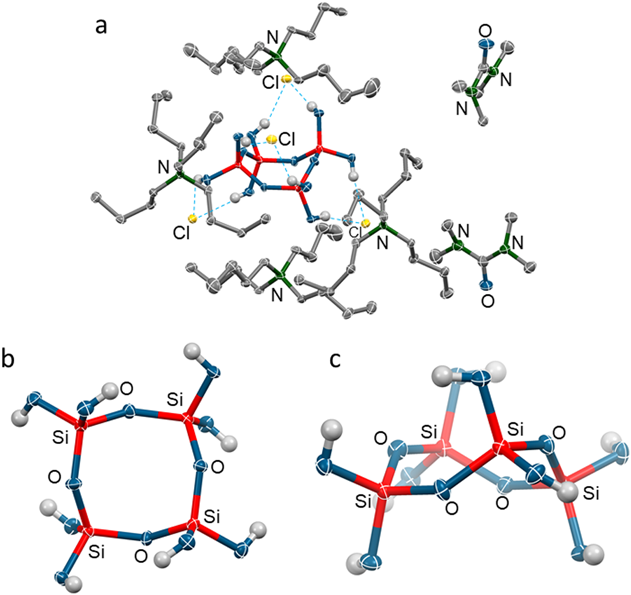
ヘキサベンジルオキシジシロキサンを前駆体として用い,同様の水素化分解を行うことで,オルトケイ酸の2量体を収率94%で合成することができた(図8:上)。この反応溶媒をDMAcからテトラメチル尿素(TMU)に置き換え,アニリンを添加せずに行うとオルトケイ酸の2量体が生成したのちに,反応系中でさらに2量化が進行して鎖状4量体が生成し,これが分子内で脱水縮合することで,オルトケイ酸の環状4量体を収率42%で得ることができた(図8:下)。なお,2量体から環状4量体へ変化する過程は29Si NMRの経時変化を追跡することにより確認した。テトラブチルアンモニウム塩(nBu4NX, X=Cl, Br)を反応溶液に加え,再結晶化させることによりアンモニウム塩と水素結合した単結晶を得ることができ,X線結晶構造解析によりその構造を明らかにした。2量体の結晶構造は1分子の2量体と2分子のアンモニウム塩からなっており,2つのヒドロキシ基が1つの塩素イオンに対し水素結合した構造であった(図9太破線)。また,残りの2つのヒドロキシ基を介してもう1分子の2量体と互いに水素結合していた(図9細破線)。Si–O–Siの結合角は154.31(8)˚であり,Si–O(Si)の平均結合長は1.6138 Åであり,Si–O(H)の平均結合長は1.6227 Åであった。
環状4量体は,1分子の環状4量体と4分子のアンモニウム塩,さらに,結晶溶媒として2分子のテトラメチル尿素を含んだ結晶構造であった。また,隣り合う2つのヒドロキシ基が1つの塩素イオンに対し水素結合していた(図10a:破線)。図10bおよび10cには環骨格を上からと横から見た図を示す。環骨格は舟形状の構造をとっていた(図10c)。また,Si–O–Siの平均結合角は140.3°であり,Si–O(Si)の平均結合長は1.623 Åであり,Si–O(H)の平均結合長は1.617 Åであった。
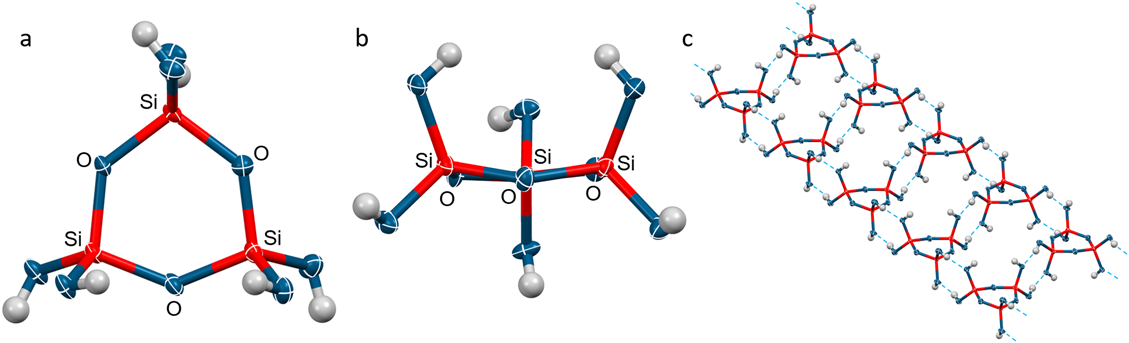
オクタベンジルオキシトリシロキサンを前駆体として用い,DMAc溶媒中において同様の水素化分解を行うと分子内で脱水縮合も進行し,オルトケイ酸の環状3量体を収率94%で合成することができた(図11)。環状3量体はテトラブチルアンモニウム塩を添加することなく,テトラメチル尿素から再結晶化することで,テトラメチル尿素を結晶溶媒として含む単結晶を得ることができた。X線結晶構造解析の結果,環状3量体の六員環骨格はほぼ平面構造であった(図12b)。また,歪んだ六員環骨格に起因し,Si–O–Siの平均結合角は131.7°と狭まっていた。Si–O(Si)の平均結合長は1.624 Åであり,Si–O(H)の平均結合長は1.607 Åであった。また,興味深いことに,2分子の環状3量体が向かい合うように水素結合し,さらにそのユニットが1次元にネットワーク化した結晶構造であることを明らかにした(図12c)。一般に環状トリシロキサンはその歪んだ六員環骨格に起因し,不安定であることが知られている。しかし,特筆すべきことに,得られた単結晶をDMAcと重THFの混合溶媒に溶解させ,29Si NMRによりその安定性を追跡したが,6か月後においても20%減少するのみであり,非常に安定であることを明らかにした。
有機合成で用いられる反応を無機化合物であるオルトケイ酸に適用し,無水条件下で合成可能な反応を開発することで,オルトケイ酸とその2量体,環状3量体,環状4量体を安定に合成することに成功した。また,それらの単結晶のX線結晶構造解析により,詳細な分子構造を明らかにした。
オルトケイ酸とそのオリゴマーを粉体として手に取ることができるようになったことから,これらをビルディングブロックとして用いた精密な合成が可能になり,さまざまな高性能・高機能ケイ素材料の開発が期待される。また,このオルトケイ酸を用いることで,革新的なシリカ製造プロセスの開発や植物や動物のシリカ摂取のメカニズム解明に貢献することが期待される。
謝辞Acknowledgments
この成果は,国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)の委託業務の結果得られたものです。
引用文献References
1) R. K. Iler, The Chemistry of Silica(John Wiley & Sons, 1979).
2) P. Tréguer, D. M. Nelson, A. J. V. Bennekom, D. J. DeMaster, A. Leynaert, B. Quéguiner, Science, 268, 375(1995).
3) J. F. Ma, K. Tamai, N. Yamaji, N. Mitani, S. Konishi, M. Katsuhara, M. Ishiguro, Y. Murata, M. Yano, Nature, 440, 688(2006).
4) J. P. Bellia, J. D. Birchall, N. B. Roberts, Lancet, 343, 235(1994).
5) K. Schwarz, D. B. Milne, Nature, 239, 333(1972).
6) E. M. Carlisle, Science, 178, 619(1972).
7) J. Berzelius, Ann. Chim. Phys., 14, 363(1820).
8) C. Friedel, J. M. Crafts, Ann. Chim. Phys., 9, 5(1866).
9) G. Jander, K. F. Jahr, Kolloid-Beihefte, 41, 48(1934).
10) D. Fortnum, J. O. Edwards, J. Inorg. Nucl. Chem., 2, 264(1956).
11) R. Ciriminna, A. Fidalgo, V. Pandarus, F. Béland, L. M. Ilharco, M. Pagliaro, Chem. Rev., 113, 6592(2013).
12) M. Igarashi, T. Matsumoto, F. Yagihashi, H. Yamashita, T. Ohhara, T. Hanashima, A. Nakao, T. Moyoshi, K. Sato, S. Shimada, Nat. Commun., 8, 140(2017).