シリカゲル表面における層状ケイ酸塩の結晶成長Crystal Growth of Layered Silicates on the Surface of Silica Gels
信州大学学術研究院(工学系)Faculty of Engineering, Shinshu University ◇ 〒380–0928 長野県長野市若里4–17–1
スメクタイト族粘土鉱物のような,シリケート層間に交換性のアルカリ金属イオンを含む層状ケイ酸塩は,分子認識的な吸着剤などとして応用が検討されている物質群である。本稿では,スメクタイト様層状ケイ酸塩を,種々の形状のシリカ表面上で直接結晶成長させ,シリカ表面を均一に被覆する方法について解説する。非晶質シリカに所定量のフッ化リチウム,塩化マグネシウムおよび尿素の水溶液を加え水熱処理すると,シリカ表面上でヘクトライト様層状ケイ酸塩の不均一核生成反応が進行する。また,出発原料にアルミニウムを添加すると,層状アルミノケイ酸塩が成長する。いずれも固体状シリカの一部のみを溶出させるので,もとのシリカの形状は損なわれない。用いるシリカの形状としては,球状粒子,ファイバー,中空状粒子等に適用できる。出発原料の化学組成が被覆の均一性や生成する微結晶の構造などへ及ぼす影響について述べるとともに,シリカの形状を活かした応用例(光学分割用カラム充填剤やフィルター,磁気回収型吸着剤など)について紹介する。
Cation-exchangeable layered silicates including smectite group of layered clay minerals have been investigated in various applications such as molecular recognizable adsorbents. Here, we overview the surface coverage of an amorphous silica with smectite-like layered silicates through the direct crystallization technique. The silica substrates (e.g., monodisperse spherical particles, fibers, hollow microspheres) undergo the heterogeneous nucleation of a hectorite-like silicate after the hydrothermal reactions with lithium fluoride and magnesium dichlorides in the presence of urea. An aluminosilicate microcrystal has also grown on the surfaces by adding aluminum ions to the initial solution. Because of partial dissolution of the silica substrates initiated by the hydrolysis of urea, the shape of the silica substrate has been maintained after the hydrothermal reactions. Cation exchange properties are displayed for the interlayer cations in the formed hectorite crystals to be replaced with metal (a rare-earth ion) and organic (quaternary alkylammonium and methylene blue) cations, as is usually observed for the smectites. We focus in this article on the reaction mechanism (affected by the chemical compositions of the starting mixtures) and applications of the resulting hybrids (e.g., HPLC column packing materials for chiral discrimination, filtering, and magnetic recovery). Such a hierarchical design including the crystal engineering on the surface of defined morphology will be useful for separation of a target molecule especially in a flow system.
キーワード:層状ケイ酸塩;不均一核生成;水熱反応;結晶成長;階層設計
Key words: layered silicates; heterogeneous nucleation; hydrothermal reactions; crystal growth; hierarchical design
© 2017 一般社団法人日本ゼオライト学会© 2017 Japan Zeolite Association
非晶質シリカの形態(morphology)は,カルシウム塩など他の無機化合物と比較して自由度が高く,球状,板状,繊維状,中空状,モノリス等様々である。また,粒子が集積して発現する物性を機能として利用することもある。球状シリカの合成と粒子径制御(Stöber法)1)は端的な一例であり,オパール(蛋白石)でみられるような遊色現象は,単分散球状シリカ粒子が3次元に集積した結果であるように,粒子形態と集積体が光物性と深く関係することがある2)。単分散な球状メソポーラスシリカ粒子の合成3)のように,シリカ粒子の階層的設計(構造と形態の双方の設計)も行われている。球状メソポーラスシリカの合成とほぼ時を同じくして,シリカ中空微粒子の合成について報告された4)。シリカ中空微粒子がナノ粒子を内包する,すなわち中空粒子壁でナノ粒子を隔離することで発現する機能(例えば多孔質な中空粒子=分子篩い,ナノ粒子=触媒活性種) についても報告されている5,6)。これらのような階層的設計により,光物性,磁気物性,触媒活性などあらゆる側面で特異な機能の発現が期待される。
筆者は,シリカ系物質の構造と形態の柔軟性に興味をもっており,吸着剤や分離材,触媒担体などの設計に取り組んでいる。構造設計としては,分子認識的な吸着活性サイトの設計であり,ナノシート「層間」という二次元微小空間を有する物質の吸着特性に着目している7–9)。特にシリケート層(1 nm程度のナノシート)が積層した粘土鉱物は,長らく研究対象となっている10,11)。粘土鉱物の中でも,スメクタイトと呼ばれる一群の層状ケイ酸塩類は,シリケート層間に交換性のアルカリ金属イオンを挟んだ結晶である12–14)。その陽イオン交換性を活かした層間修飾により,分子認識的な吸着剤や触媒担体などとしての応用に展開する例もみられる7,15–19)。他方,形態制御(粒子径,結晶子サイズ,形状)も材料としての応用性を高めるうえでは注視すべき観点である。一般に粉末を流通系で用いる場合,しばしば圧力損失による接触効率の低下によって機能が低下することがある。流体透過性に優れた多孔体(モノリス)20)は支持体として有用と考えられる。他方,分子篩い機能を備える粒子を支持体に担持する場合では,支持体との化学反応を利用して,担体表面から直接粒子成長させる方法がある。図1のように,支持体(A)を溶媒と接触させることで部分溶解させ,一方の溶媒からは目的粒子の成分(B)を供給すると,支持体表面で不均一核生成反応が進行し,目的粒子 (AB:多くは結晶質物質) が成長することがある。支持体の一部が溶解し,これが目的粒子の構成成分となることから,この方法は犠牲鋳型法(sacrificial template method)や自己鋳型法(self-template method),in situ結晶化(in situ crystallization)などと呼ばれる。用途に応じて支持体を選択し,その表面で所望の微結晶を支持体の形状を損ねることなく成長させることができれば,微結晶のミクロな性質と支持体のマクロな性質の双方を機能として有効に活用できると期待される。
本稿では,犠牲鋳型法で固体表面から無機結晶が成長する例について,シリカ(犠牲鋳型)–層状ケイ酸塩(目的結晶)の組み合わせを中心に発現する機能を交えながら紹介する。
非晶質の支持体から直接成長する無機多孔質結晶の代表例は,ゼオライト類である。アルミノケイ酸塩ゼオライトの不均一核生成反応では,支持体側からSiおよびAlが供給され,溶液側からはNaを供給する。気相流通で応用することを念頭に,繊維状あるいはハニカム状の支持体が用いられている。繊維状シリカアルミナ(Si/Al=1)を支持体にして,NaOHの添加によって部分溶出させると,支持体のSi/Al比を反映してSi/Al=1のA型ゼオライトが繊維表面で生成する21)。コージェライト(Si/Al=1.25)の場合では,硫酸処理によってシリカリッチな表面を露出させ (これが結晶化を促進させる),これにメタカオリナイト(Si/Al=2)を含浸したうえでNaOHと水熱反応させると,図2のようにA型ゼオライトが接着すると報告されている22)。ゼオライト骨格中のSi/Alは支持体の組成を強く反映しているので,Si/Alを調節する場合は,2種類の支持体を混合することも有用である。例えば,シリカ繊維(SO)とシリカアルミナ繊維(SA)を混合して溶液側からNaを供給すると,SA/(SO+SA)が0.1~0.6ではX型ゼオライトが生成する23)。
Alフリーのゼオライトでは,支持体にシリカが用いられる。繊維状シリカ(市販のガラス製ろ紙)表面でシリカライト-1の結晶を育成するには,溶液側からテトラエチルオルソシリケートと構造規定剤としての水酸化テトラプロピルアンモニウムを供給する24)。ハニカム型カオリンを高熱処理すると,シリカガラスと多孔質なムライト(Si/Al=0.33)の混合物になる。NaOHを水溶液中で接触させるとシリカガラス成分が選択的に溶出するので,これと構造規定剤(テトラプロピルアンモニウムブロミド)との反応によって,多孔質化したムライトの表面にZSM-5(Al含有量は少ない)が結晶成長する25)。
無機層状物質では,層状複水酸化物(LDH)の不均一核生成反応が層状ケイ酸塩に先んじて報告されている。LDHは,[M21+−xMx3+(OH)2][Anx−/n·yH2O]で表される陰イオン交換性の複水酸化物である。例えば,Mg2+およびAl3+の組み合わせで層間にCO32−を含むものはハイドロタルサイトと呼ばれ,合成物は工業製品として入手可能である。LDHはケイ酸塩系ではないので本解説の趣旨からは外れるが,インターカレーション能を具備する点では共通であるため紹介したい。均一核生成反応によりLDHを得るには,所定の濃度とモル比の二価および三価金属イオンを含む混合水溶液をpH調整して,金属イオンを加水分解する方法が多く見られる26–28)。また,金属水酸化物ゲルをあらかじめ調製しこれを所定のモル比で混合した後加熱することで合成する方法や,二種の水酸化物粒子同士を反応させる例29,30)もある。LDH粒子(結晶)そのものの形態制御法も検討されており,尿素31)やヘキサメチレンテトラミン32)を沈殿剤に用いると,長径数µmの比較的大きくかつ粒径の揃ったLDHの結晶が得られる。
Duanら33)は陽極酸化ポーラスアルミナ(アルミニウムを酸性の電解液中で陽極酸化した際に形成される酸化皮膜)基板表面からのNi/Al系LDHの微結晶育成に成功している。LDHを構成するNi2+を水溶液から供給し,Al3+をポーラスアルミナ基板から供給すると,図3のように厚み約2 µmのLDH結晶が垂直かつち密に配向した膜が形成する。このLDH結晶の層間をイオン交換により疎水化すると,表面の凹凸の均一性も反映して,超はっ水性を示すようになる。同様の方法でZn/Al系LDHの結晶育成も行っている34)。また,Zhangらは繊維状アルミナとMg塩35)またはZn塩36)を水熱反応させると,Mg/Al系またはZn/Al系LDHの微結晶(0.4~0.8 µm)が繊維状アルミナ表面上でそれぞれ成長することを報告している。
a)は真上から観察した像,b)はa)の拡大像,c)は断面SEM像,d)は深さ方向のEDX線分析結果.Ref. 33, Wiley-VCHより許可を得て転載.
スメクタイトやアルカリシリケート,膨潤性雲母などの層状ケイ酸塩は,水溶液からの沈殿反応や水熱反応,固相・融液反応などにより得られる37–39)。水熱合成スメクタイトの中でもヘクトライト様層状ケイ酸塩(理想組成:Lix(Lix, Mg6−x)Si8O20(OH)4,以下ヘクトライトと呼称)は,比較的温和な条件で得られ,シリカゾルとLi塩,Mg塩,およびアルカリを混合して反応させる40–45)。ヘクトライトの不均一核生成反応には,支持体として非晶質シリカが用いられ,ヘクトライトを構成する成分のうちSiは支持体側から,Li, Mgは溶液側から塩基性条件下で供給している。例えば,図4(a)のように単分散球状シリカの水懸濁液にLiF,MgCl2および尿素を加え水熱反応させると,尿素の加水分解でpHが上昇することで球状シリカが一部表面から溶出し,Li+およびMg2+とが反応してヘクトライトの不均一核生成反応がシリカ表面で進行する46)。添加するLiおよびMg量を従来のヘクトライト合成条件(Li : Mg : Si=1.4 : 5.3 : 8.0)41)と比較して2割に減らして水熱反応(100°C48時間)すると,もとのシリカ形状と粒度分布幅をほとんど変えることなく,粒子表面に多数の微細な凹凸 (ヘクトライト) が現れる。TEMの表界面観察(図4(b)および4(c))ではもとの平滑なシリカ(図4(d))とは異なり,厚さ1 nm程度のシリケート層がスタックした様子がみられ,シリカ表面とシリケート層が接着した様子もみられる。
Ref. 46, アメリカ化学会より許可を得て転載.
この反応はシリカ表面で進行するので,出発物質に粉末状のシリカ粒子を用いる場合,水熱反応中に水溶液とシリカ表面を十分に接触させる必要がある。そのためテフロン内筒型密閉容器に封入する前に,室温であらかじめシリカ粒子を水溶液と十分なじませておく(このとき尿素は加水分解されないので,水溶液のpHは上昇せずシリカの溶出は起こらない)。また,シリカ表面を均一にヘクトライトで被覆するには水熱反応中でも撹拌することが好ましく,ゼオライト合成でも多用されるようなオートクレーブごと回転できる装置を用いると,もとのシリカが凝集したまま反応が進行するといった不均一性が回避できる47)。生成したヘクトライト層間へは,陽イオン性界面活性剤(ジオクタデシルジメチルアンモニウム,2C18N+と略記)がイオン交換反応によってインターカレートする。2C18N+のような嵩高な陽イオンをヘクトライト層間に取り込むと,層間が拡大(膨潤)する。この層間距離の拡大を反映して,図5のように単分散で球状の被覆粒子径が増大した。加えたシリカ粒子全体が均一にヘクトライトで被覆されていることを示唆する結果といえる。
支持体としてのシリカは形状が多様であることから,用途に応じその形状を選択できる点が特徴といえる。筆者らは,単分散球状シリカ粒子だけでなく,クロマト用シリカゲル(不定形)48)やガラス製のろ紙(繊維状シリカ)49),中空シリカ粒子50)それぞれの表面で成長するヘクトライトの機能ついても検討している。ヘクトライトの不均一核生成について基礎的な検討も意図しており,次のようにいくつかの知見が得られている。
シリカ表面上におけるヘクトライトの不均一核生成に関して,出発原料(Li+,Mg2+,SiO2および尿素)の仕込み比が,反応に及ぼす影響について述べる。シリカ表面上におけるヘクトライトの典型的な仕込み比は,LiF : MgCl2 : SiO2 : urea=0.21 : 0.8 : 8 : 8(モル比)であり,100°C48時間で水熱反応させることを基本としている。
3.2.2.1. Li/Mg比47)ヘクトライトの理想組成は,Mx(Lix, Mg6−x)Si8O20(OH)4であり,Mg2+の一部がLi+に同形置換されることでシリケート層は負の永久電荷をもつ。交換性陽イオン(Mn+)は一般にはLi+であるが,本系では尿素の加水分解によって生ずるNH4+が負電荷を補償している。よってLi/Mg比が異なると,層表面負電荷密度も異なる。そこで,表1に示すLi/Mg比で4種の試料S1~S4を調製し,試料の陽イオン交換容量(CEC)を測定した。陽イオン性色素であるメチレンブルー(MB+Cl−)はCECの計測に有用な試薬の一つである。Langmuir式に回帰して得られた吸着平衡定数Kおよび飽和吸着量qmを表1に示す。合成時に添加するLiFを増やすことでqmが増大する結果となった。
| 試料名 | 仕込みモル比 LiF : MgCl2 : SiO2 : urea | 2C18N+ | MB+ Langmuirパラメータ | ||
| 基本面間隔 [nm] | 吸着量 [mmol/g] | K [103 L/g] | qm [mmol/g] | ||
| S1 | 0.21 : 0.80 : 8.0 : 8.0 | 1.9 | 0.11 | 5.7 | 0.12 |
| S2 | 0.42 : 0.69 : 8.0 : 8.0 | 2.3 | 0.16 | 4.3 | 0.17 |
| S3 | 0.63 : 0.69 : 8.0 : 8.0 | 2.2 | 0.19 | 4.7 | 0.19 |
| S4 | 0.84 : 0.69 : 8.0 : 8.0 | 2.5 | 0.23 | 2.0 | 0.23 |
| Langmuir式:(C:平衡濃度,qm:飽和吸着量,K:平衡定数) | |||||
2C18N+で飽和させた場合,ヘクトライトの基本面間隔は表1に示す値となった。図6のように2C18N+はS1の層間では二分子層,S2およびS3では擬三分子層,S4ではパラフィンタイプで配向していると考えられる。この配向の違いは,層表面電荷密度の違いを直接反映しており,添加するLi/Mg比を増やすことで,シリカ表面上のヘクトライトの電荷密度が増大することを実験的に示している。また,シリカ表面のヘクトライトに吸着される2C18N+量とその配向 (層電荷密度) によって,複合体に含まれるヘクトライトの割合を見積もることができる。表1にTG-DTA分析から計算した2C18N+の吸着量をまとめた。例えば,S1では2C18N+の吸着量は0.11 mmol/g·sampleであり,層間の2C18N+の配向は二分子層である。二分子層の配向をとる場合のヘクトライトのCECは,0.5~0.6 meq/g·hectorite43)であることを考慮すると,試料中の2割がヘクトライトであると見積もられる。S2~S4についても同様に計算すると,いずれもヘクトライトの割合は2割程度である。
3.2.2.2. 尿素49,50)尿素は70°C以上で加水分解されNH4+とOH−を生成し,水溶液のpHを上昇させる。これによってシリカ粒子が溶出するので,水溶液の体積を一定にして添加する尿素量を変えると,シリカの溶出量も変わる。尿素添加量(シリカ溶出量)とヘクトライト生成量との関係について調べるため,原料シリカとして,マグネタイト (Fe3O4) を内包した中空シリカカプセル52)を用いた。塩基性の水熱条件下ではマグネタイトが変質し磁性が失われるので,磁化の減少をシリカカプセルの溶出量とみなし,磁化の値とヘクトライトの生成量との関係を求めた。その結果,表2のように尿素添加量を多くすると,磁化が低下(すなわちシリカ溶出量が増大)し,ヘクトライトの生成量も増える傾向となった。繊維状シリカ(直径数µm)を支持体として,典型的な仕込み比(LiF : MgCl2 : SiO2 : urea=0.21 : 0.8 : 8 : 8)で反応させた場合では,シリカの溶出量が多いために繊維が細くなり機械的強度が低下した(図7(a))。また,溶出シリカが溶液中で重合し,図7(b)のように数百nm程度の球状シリカが共生した(この球状シリカ表面は,図7(c)の模式図のようにヘクトライトの不均一核生成の場にもなる)。尿素の添加量のみを1/4に減らすと,繊維状シリカの破断や球状シリカの共生がみられなくなり,溶出シリカのほとんどがヘクトライトの不均一核生成に使われ,図7(d)および(e)のように繊維状シリカと複合化した。
| Sample | LiF : MgCl2 : SiO2 : urea | CEC [10−5 eq/g] | Ms [emu/g] |
| FexOy@SiO2 | — | — | 4.0 |
| F15 | 0.21 : 0.8 : 8 : 8 | 2.9 | 0.78 |
| F15–1/4 | 0.21 : 0.8 : 8 : 2 | 1.6 | 3.4 |
| F15–1/800 | 0.21 : 0.8 : 8 : 0.01 | 0.36 | 4.0 |
| F30 | 0.42 : 1.6 : 8 : 8 | 6.1 | 0.71 |
| F30–1/4 | 0.42 : 1.6 : 8 : 2 | 4.3 | 0.85 |
| Ref. 50, Elsevierより許可を得て転載. | |||
(a)尿素の添加量が多いと反応容器の底に堆積する破断=したシリカ繊維と(b)球状粒子(表面はヘクトライトと思われる)(c)a, bの生成過程をまとめた模式図,(d)尿素の添加量を減らすとcの反応は起きず,均一にヘクトライトで被覆された繊維のみみられる,(e)生成物dの断面図.Ref. 49, 王立化学会より許可を得て転載.
フッ素イオンは,鉱化剤として作用しシリカの溶出を促進することが知られている。出発組成のモル比を変えずに,ヘクトライトのLi源をLiFからLiClに変更すると,試料のCECが減少した(ヘクトライトの生成量が減少したことと対応している)。同時に(001)回折線強度が弱まりヘクトライトの結晶子サイズも若干小さくなる(表面の凹凸が小さくなる)傾向にあった。ヘクトライト生成に必要なシリカの溶出量が減少したためと考えられ,尿素のほかにLiFの添加量もヘクトライトの生成量に関与していることを示す結果が得られている。
3.2.2.4. Siに対するLiおよびMgの添加量49,50)典型的な仕込み比(LiF : MgCl2 : SiO2 : urea=0.21 : =0.8 : 8 : 8)を基準に,LiおよびMgの添加量のみを増やすと,表2のようにヘクトライトの生成量が増大することがある。Li+およびMg2+の他に,F−の添加量も増やしているため,3.2.2.3で記述したように,ヘクトライト源としてのシリカが支持体から多く供給されており,これを反映してヘクトライトの生成量が増えたと解釈している。原理的には,LiFおよびMgCl2の添加量を増やすほどヘクトライトの生成量が増大することになるが,支持体に固定化できるヘクトライトの量は,支持体の表面積に依存するため,その量には限度があると考えられる。
層状物質の支持体への固定化は,吸着・分離応用において検討すべき点である。とくにヘクトライトなどの層電荷密度が比較的小さいスメクタイト族粘土鉱物では,水中で容易に膨潤し,支持体に固定されていないものは剥離(exfoliation)する可能性がある。筆者らは,種々の陽イオン(Li+, Ca2+, Eu3+)の水溶液での吸着特性から,シリカ表面で成長したヘクトライトの化学的安定性について検討している。マグネタイトを内包したシリカカプセルとの複合物では,2Na+⇆Ca2+の繰り返し反応後でも,表面のヘクトライト微結晶の構造をほとんど変えずに,永久磁石によってイオンが吸着した複合物を回収できる50)。図8(a)のように,3Na+⇆Eu3+の交換反応においても繰り返し性がみられ,繊維状シリカを支持体とした場合では,Eu3+の発光は繊維全体に分布しており(図8(b)),シリカ表面のヘクトライト全体でイオン交換反応が進行したことがわかる49)。MB+Cl−の通液試験では,CECと同程度の量で破過しており,破過後でも成型体(フィルター)の変形はほとんどなく全体がMB+で着色されていることもわかる(図8(c))。あえて成型体からヘクトライトの剝離を促すため,12 mM LiCl水溶液に3週間浸してみたが,剥離した量は7%未満であった (図8(d))。この試料は,直径数µmの繊維状シリカにLiF : MgCl2 : =SiO2 : urea=0.21 : 0.8 : 8 : 2の組成で反応させたものであり,試料中にヘクトライトが15%程度含まれている。もとのシリカの表面積(粒子径あるいは繊維直径)とヘクトライト含有量が,剝離する量とどのように関係するかについて系統的に整理すると,ヘクトライトのシリケート層がシリカに接着する面積密度が求まると考えられる。また,シリカに直接接着せず,静電的な相互作用で付着したヘクトライトが存在する場合,次に示すような加圧流通系での応用の際,剝離が起き圧力損失の原因となりうる。
Ref. 49, 王立化学会より許可を得て転載.
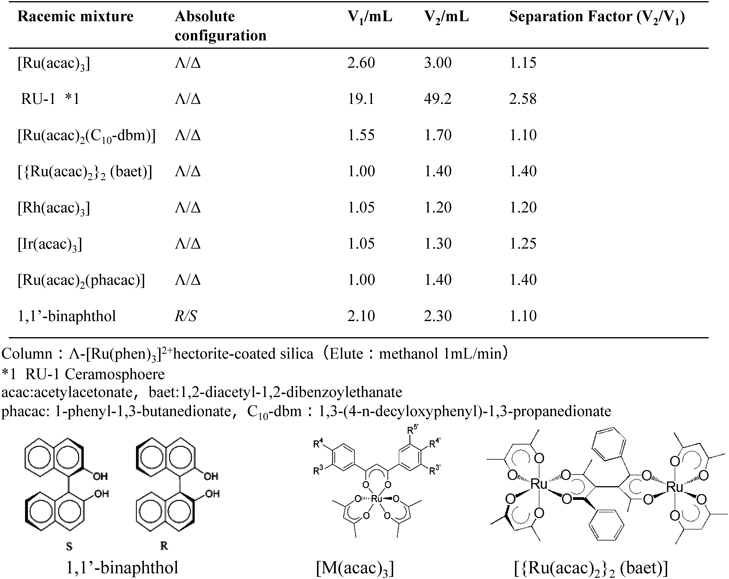
シリカ表面のヘクトライト相(殻)の厚みは薄いため,ヘクトライト相を出入りする分子の物質移動抵抗は小さいと予想できる。筆者らは,溶離液の使用量を極力抑えることのできる光学分割用HPLCカラム充填剤の応用を検討した。キラルな金属錯体が層状ケイ酸塩に吸着する現象については,山岸皓彦東大名誉教授,愛媛大学佐藤久子教授らによって次のように説明されている。D3対称性を有するトリスキレート型錯体である[Ru(phen)3]2+(phen=1,10-フェナントロリン)や[Ru(bpy)3]2+(bpy=2,2′-=ビピリジル)では,隣り合った錯体間で立体選択的な相互作用が働き,その結果エナンチオマーとラセミ混合物では飽和吸着量に大きな差が生じる53)。エナンチオマーの場合には図9の右側のように立体的な反発によって吸着分子は隙間のある配列をとる54)。分子間にできたミクロな隙間はキラルであり,そこに別の分子が吸着したり化学変化を起こす時には大きな不斉識別効果が表れる。この原理に基づくと,金属錯体を吸着させた層状ケイ酸塩の球状粒子は,光学分割用HPLCカラム充填剤に応用でき,種々のラセミ混合物に対して高い分離能や保持容量を示すことが報告されている55,56)。溶離に要する時間を抑え(分子拡散距離および吸着平衡に要する時間を短く),少量の有機溶媒で溶離を完了させるため,層状ケイ酸塩がシリカ粒子表面に接着した複合体に置き換えて試してみた。HPLCカラム充填剤用の比較的安価なシリカゲル(粒子径約5 µm)を出発物質として調製し,シリカ表面で生成した層状ケイ酸塩層間にΔ-[Ru(phen)3]2+を取り込むと,例えば図10のように[Ru(acac)3](acac=アセチルアセトナート)のラセミ混合物がΔ体とΛ体に光学分割され,球状に固めたカラムと比べて分割に要する時間が短くなった。流速を変えてもピークの形状(半値幅)はほとんど変化がなかった。ラセミ混合物としては,[Ru(acac)3]だけでなく,表3のように各種有機金属錯体や有機分子に対しても,同様の結果が得られている。圧力損失もほとんどなく,接着したナノシートの剝離はほとんどないと考えられる。
左側:ラセミ混合物の場合,右側:エナンチオマーの場合(錯体間に隙間がある).Ref. 54, 王立化学会より許可を得て転載.
Δ-[Ru(phen)3]2+修飾ヘクトライトが光学活性であり,左がシリカ被覆型,右が市販の球状ヘクトライトを用いた場合である.RU-1:球状ヘクトライトをΔ-[Ru(phen)3]2+で修飾した市販カラムの商品名.Ref. 48, Oxford Academicより許可を得て転載.
 |
| Ref. 48, Oxford Academicより許可を得て転載. |
犠牲鋳型法で固体表面から無機結晶が成長する例について,シリカ表面上におけるLiO–MgO–SiO2系層状ケイ酸塩(ヘクトライト)の不均一核生成反応を中心に紹介した。この反応は,出発シリカの形状に関係なく進行する。加えて出発原料の化学組成によって,ヘクトライトの生成量,層電荷密度,および結晶性に影響を与える。特にヘクトライトの層電荷密度は,層間陽イオンの平均空間充填密度と直接的に関係し,これが吸着選択性などの機能にも影響を与える。同様の方法でSiO4四面体のAl3+への同形置換型(サポナイト様)57)やチタノシリケート58)もシリカ表面上で結晶育成できることも報告されている。支持体の形状・サイズを適切に選択しつつ,出発組成を考慮することによって,とくに流通系で高い吸着・分離機能を発揮できる結晶デザインが提案されることを期待したい。
1) W. Stöber, A. Fink, E. Bohn, E. J. Colloid Interface Sci., 26, 62 (1968).
2) 最近の総説として,Y. Takeoka, J. Mater. Chem. C, 1, 6059 (2013).
3) M. Grün, I. Lauer, K. K. Unger, Adv. Mater., 9, 254 (1997).
4) F. Caruso, R. A. Caruso, H. Möhwald, Science, 282, 1111 (1998).
5) G. Prieto, H. Tüysüz, N. Duyckaerts, J. Knossalla, G.-H. Wang, F. Schüth, Chem. Rev., 116, 14096 (2016).
6) 岡田友彦,油中水滴分散型エマルションを利用した中空粒子合成,「中空微粒子の合成と応用(藤正督監修)」,シーエムシー出版,pp.86–97 (2016); T. Okada, K. Miyamoto, T. Sakai, S. Mishima, ACS Catal., 4, 73 (2014); T. Okada, Y. Takeda, N. Watanabe, T. Haeiwa, T. Sakai, S. Mishima, J. Mater. Chem. A, 2, 5751 (2014).
7) T. Okada, Y. Ide, M. Ogawa, Chem.-Asian J., 7, 1980 (2012).
8) Y. Ide, M. Sadakane, T. Sano, M. Ogawa, J. Nanoscience Nanotechnol., 14, 2135 (2014).
9) T. Okada, M. Ogawa, Chapter 6. Inorganic–organic interactions. in Inorganic Nanosheets and Nanosheet-Based Materials, Ed. by T. Nakato, J. Kawamata, S. Takagi, Springer, pp. 163–186 (2017).
10) M. Ogawa and K. Kuroda, Chem. Rev., 95, 399 (1995).
11) 「CSJカレントレビュー25二次元物質の科学」(日本化学会編),化学同人 (2017).
12) 白水晴雄,「粘土鉱物学(新装版)-粘土科学の基礎」,朝倉書店 (2010).
13) 「粘土ハンドブック第3版」(日本粘土学会編),技報堂 (2011).
14) 「機能性粘土素材の最新動向」(小川誠監修),シーエムシー出版(東京) (2010).
15) T. Okada, M. Ogawa, Chapter 9. Adsorbents derived from layered solids. in Inorganic Nanosheets and Nanosheet-Based Materials, Ed. by T. Nakato, J. Kawamata, S. Takagi, Springer, pp. 263–301 (2017).
16) 最近の総説として,T. Okada, Y. Seki, M. Ogawa, J. Nanosci. Nanotech., 14, 2135 (2014).
17) Y. Seki, Y. Ide, T. Okada, M. Ogawa, Appl. Clay Sci., 109–110, 64 (2015).
18) T. Okada, J. Oguchi, K. Yamamoto, T. Shiono, M. Fujita, T. Iiyama, Langmuir, 31, 180 (2015).
19) T. Okada, T. Yoshida, T. Iiyama, in press.
20) K. Nakanishi, N. Tanaka, Acc. Chem. Res., 40, 863 (2007).
21) K. Okada, H. Shinkawa, T. Takei, S. Hayashi, A. Yasumori, J. Porous Mater., 5, 163 (1998).
22) K. Okada, Y. Kaemshima, C. D. Madhusoodana, R. N. Das, Sci. Tech. Adv. Mater., 5, 479 (2004).
23) K. Okada, K. Kuboyama, T. Takei, Y. Kameshima, A. Yasumori, M. Yoshimura, Microporous Mesoporous Mater., 37, 99 (2000).
24) L. Tosheva, V. Valtchev, Microporous Mesoporous Mater., 81, 11 (2005).
25) H. Katsuki, S. Furuta, S. Komarneni, J. Am. Ceram. Soc., 83, 1093 (2000).
26) Layered Double Hydroxides, Ed. by X. Duan, D. G. Evans, Springer-Verlag, Heidelberg (2006).
27) 日比野俊行,粘土科学,42, 139 (2003).
28) 成田榮一・會澤純雄,層状複水酸化物(ハイドロタルサイト様化合物),「機能性粘土素材の最新動向(小川誠監修)」シーエムシー出版,pp.43–58 (2010).
29) Z. P. Xu, G. Q. Lu, Chem. Mater., 17, 1055 (2005).
30) K. Kuramoto and M. Ogawa, Bull. Chem. Soc. Jpn., 84, 675 (2011).
31) M. Ogawa, H. Kaiho, Langmuir, 18, 4240 (2002).
32) J. Liang, R. Ma, N. Iyi, Y. Ebina, K. Takeda, T. Sasaki, Chem. Mater., 22, 371 (2010).
33) H. Chen, F. Zhang, S. Fu, X. Duan, Adv. Mater., 18, 3089 (2006).
34) F. Zhang, L. Zhan, H. Chen, S. Xu, D. G. Evans, X. Duan, Angew. Chem. Int. Ed., 47, 2466 (2008).
35) T. Zhang, Y. Zhou, X. Bu, J. Xue, J. Hu, Y. Wang, M. Zhang, Microporous Mesoporous Mater., 188, 37 (2014).
36) T. Zhang, Y. Zhou, M. He, Y. Zhu, X. Bu, Y. Wang, Chem. Eng. J., 219, 278 (2013).
37) 山田裕久・田村堅志,合成法(粘土鉱物の合成と安定関係)「粘土ハンドブック第3版」pp.192–196, 技報堂 (2009).
38) J. T. Kloprogge, S. Komarneni, J. E. Amonette, Clays Clay Miner., 47, 529 (1999).
39) K. A. Carrado, Appl. Clay Sci., 17, 1 (2000).
40) B. S. Newmann, K. G. Sansom, Clay Miner., 8, 389 (1970).
41) K. A. Carrado, P. Thiyagarajan, K. Song, Clay Miner., 32, 29 (1997).
42) M. Jaber, J. Miehé-Brendlé, Microporous Mesoporous Mater., 107, 121 (2008).
43) M. Ogawa, T. Matsutomo, T. Okada, J. Ceram. Soc. Jpn., 116, 1309 (2008).
44) T. Okada, T. Matsutomo, M. Ogawa, J. Phys. Chem. C, 114, 539 (2010).
45) M. Stöter, D. A. Kunz, M. Schmidt, D. Hirsemann, H. Kalo, B. Putz, J. Senker, J. Breu, Langmuir, 29, 1280 (2013).
46) T. Okada, S. Yoshido, H. Miura, T. Yamakami, T. Sakai and S. Mishima, J. Phys. Chem. C, 116, 21864(2012);特許6029052,スメクタイト被覆シリカ粒子及びその製造方法.
47) T. Okada, A. Suzuki, S. Yoshido and H. M. Minamisawa, Microporous Mesoporous Mater., 215, 168 (2015).
48) T. Okada, A. Kumasaki, K. Shimizu, A. Yamagishi, H. Sato, J. Chromatogr. Sci., 54, 1238(2016);特開2016–057067,カラム充填剤及び高速液体クロマトグラフィー装置.
49) T. Okada, K. Shimizu, T. Yamakami, RSC Adv., 6, 26130 (2016).
50) T. Okada, H. Kobari, T. Haeiwa, Appl. Clay Sci., 132–133, 320 (2016).
51) T. Okada, A. Suzuki, Clay Sci., 19, 45 (2015).
52) T. Okada, S. Ozono, M. Okamoto, Y. Takeda, H. M. Minamisawa, T. Haeiwa, T. Sakai, S. Mishima, Ind. Eng. Chem. Res., 53, 8759 (2014).
53) A. Yamagishi and M. Soma, J. Am. Chem. Soc., 103, 4640 (1981).
54) H. Sato, A. Yamagishi, S. Kato, J. Am. Chem. Soc., 114, 10933 (1992).
55) A. Yamagishi, J. Am. Chem. Soc., 107, 732 (1985).
56) A. Yamagishi and H. Sato, Clays Clay Miner., 60, 411 (2012).
57) T. Okada, M. Sueyoshi, H. M. Minamisawa, Langmuir, 31, 13842 (2015).
58) J. Pérez-Carvajal, P. Aranda, A. Berenguer-Murcia, D. Cazorla-Amorós, J. Coronas, E. Ruiz-Hitzky, Langmuir, 29, 7449 (2013).
This page was created on 2017-07-19T09:20:57.887+09:00
This page was last modified on
このサイトは(株)国際文献社によって運用されています。