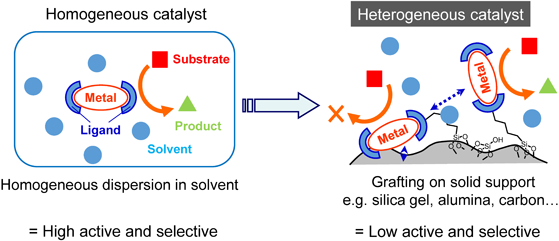
金属錯体触媒は,不斉,メタセシス,クロスカップリングなどの高度な有機反応に対し優れた触媒特性を示すため,医薬品や化成品などの工業生産に幅広く利用されている1)。工業生産においては,金属錯体触媒を反応溶液に完全に溶解させて使用する均一系触媒反応が依然として利用されている。均一系触媒反応では,触媒の回収・再利用が困難であり,また触媒から流出する金属が最終製品である医薬品や化成品に混入することを避けるために,金属の除去に複雑な操作を必要としていた。そこで,金属錯体触媒を不溶性の担体に固定化して,回収・再利用を容易にする試みが,経済性や安全性のメリットに加え,環境負荷低減や資源有効活用のための化学技術,いわゆるグリーンケミストリーの観点で活発に取り組まれてきた(Fig. 1)2)。これらの中には触媒の回収・再利用に成功した例もあるが,多くの場合で固定化後に金属錯体の触媒機能が低下することが問題となっていた。例えば,シリカゲルの表面に分子の紐(リンカー)を介して間接的に結合した金属錯体は,その活性部位が固体表面あるいは隣接する金属錯体と相互作用する不均一な環境にあるため,溶液に溶けた均一な環境とは異なり,触媒の活性や選択性が低下する場合があった3)。また,担体からの金属錯体の溶出を完全に防ぐことは,従来のリンカーを使った間接的な固定化技術では難しいことも分かってきた。このような背景のもと,金属錯体の固定化に有効な新たな技術の創出が求められていた。
1999年,我々はメソポーラス有機シリカ(Periodic Mesoporous Organosilica: PMO)の合成を報告した4)。PMOは,物質拡散に有利な大きな細孔(直径:2~30 nm)と,有機基を組み込んだ機能性の骨格構造を有する。多様な有機基が導入されており,これまでに可視光吸収・発光,ホール輸送,電子ホッピング,光触媒,金属イオン吸着などの機能を骨格自体に付与することに成功している5)。最近,金属錯体の典型的な配位子である2-フェニルピリジンと2,2′-ビピリジン基をPMO骨格に導入することに成功した6,7)。これらの配位子は細孔表面に露出しているために,金属錯体をリンカーなしに表面に直接形成することができる。また,これらのPMOの細孔表面には,配位子が規則配列した比較的均一な環境が形成されている。この均一な細孔表面に金属錯体を直接固定する新しい固定化技術の構築により,従来問題となっていた触媒機能の低下や金属の溶出が克服できる可能性がある。
ここでは,2,2′-ビピリジンを導入したPMO(BPy-PMO)の合成と金属錯体の直接形成,そしてBPy-PMOを固体配位子とした芳香族化合物の直接C–Hホウ素化反応について報告する7)。
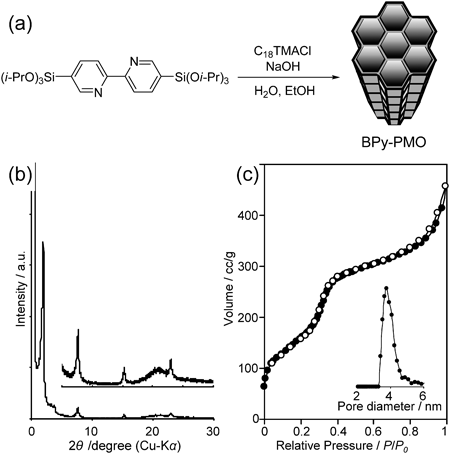
BPy-PMO合成に用いる架橋型有機シランは,これまでに報告された結晶状PMO 8)の骨格有機基の分子設計に習い,2,2′-ビピリジンの軸方向の5,5′-位にアルコキシシリル基を導入した有機シランを原料として用いた。BPy-PMOは,有機シラン原料をカチオン性界面活性剤の存在下,塩基性水溶液中で加水分解・重縮合した後,酸性エタノール溶液中で鋳型界面活性剤を除去することで得た(Fig. 2a)。BPy-PMOのX線回折パターンには,規則的なメソ構造に起因する低角のピーク(d=4.5 nm)と,細孔壁内のビピリジン基の規則配列に起因するd=1.16,0.58,0.39 nmのピークが観察された(Fig. 2b)。窒素吸着等温線は,均一メソ細孔に典型的なⅣ型を示した。等温線から求めた細孔直径は3.8 nm, 比表面積は739 m2/g, 細孔容量は0.41 cm3/gとなった(Fig. 2c)。
Fig. 3にBPy-PMOの電子顕微鏡写真を示す。SEM写真から粒径は200~500 nm程度の球形であることがわかった(Fig. 3a)。TEM写真からは,一次元のトンネル状細孔が粒子を貫通していること(Fig. 3b),細孔がヘキサゴナルに配列していること(Fig. 3c),そして,細孔と垂直方向に多数の格子縞(d=~1.2 nm)が存在していることがわかる(Fig. 3d)。この格子縞は,X線回折パターンの広角側のピークに対応しており,細孔壁中でビピリジン基が規則配列していることを示している。
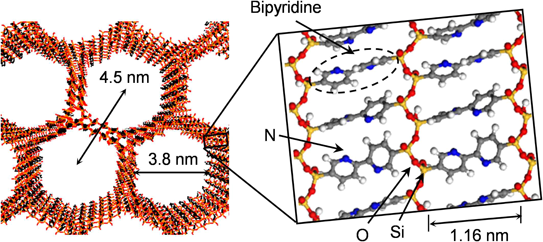
上記の構造解析に基づき決定したBPy-PMOの構造モデルをFig. 4に示す。ビピリジン基の両端は,シロキサン層により固定されており,ビピリジン層とシリカ層が1.16 nmの間隔で細孔方向に配列している。隣接するビピリジン基との平均距離は,シミュレーションにより0.44 nmと見積もられたが,これは通常のπ-πスタッキングの距離(0.35 nm)よりも長く,ビピリジン基同士の相互作用が比較的弱いと推定される。類似した化学構造を有するビフェニルPMOでは,ビフェニル基が両端のSi-C結合を軸に回転していることが固体NMR解析により確認されているため9),ビピリジン基も回転の自由度を有すると考える。
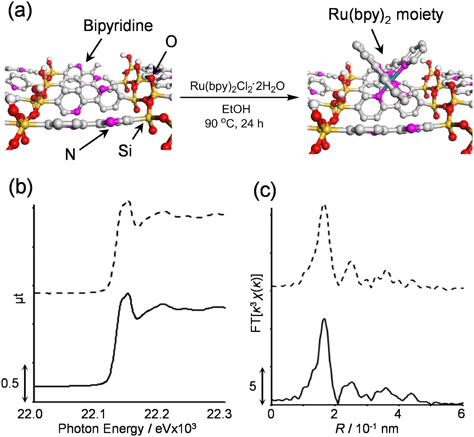
このようにBPy-PMOの骨格中のビピリジン基は,比較的ゆるく充填されており,その反応性が保持されている可能性があるため,配位子の一つとして金属錯体の形成が期待される。我々はまず,典型的な金属錯体であるトリス(2,2′-ビピリジル)ジクロロルテニウム錯体(Ru(bpy)3Cl2)の形成を試みた。Ru錯体の前駆体(Ru(bpy)2Cl2·2H2O)溶液にBPy-PMO粉末を分散させ,90°Cで24時間加熱処理を行ったところ,細孔表面にRu錯体が形成できた(Fig. 5a)。拡散反射及び発光スペクトルには,Ru(bpy)3Cl2に典型的なMLCTの吸収とリン光が観察された。また,Ru(bpy)2(BPy-PMO)のXANESおよびEXAFSスペクトルは,均一系のRu(bpy)3Cl2のスペクトルとよく一致した(Figs. 5b and 5c)。ICP分析から,Ru錯体の固定量は,BPy-PMO中のビピリジン基の約6%であることが分かった。我々は,これまでに,Ru錯体だけでなく,Re,Pd,Ir錯体の形成も可能であることを確認した7)。
3. BPy-PMOを固体配位子に用いた芳香族化合物のC–Hホウ素化反応
有機ホウ素化合物は,液晶材料,医薬品合成における重要な合成中間体である10)。有機ホウ素化合物を用いたクロスカップリング反応は,工業的に幅広く利用されているため,2010年に鈴木らにノーベル化学賞が授与されている11)。近年,有機ホウ素化合物の合成法として,遷移金属触媒を用いたC–Hホウ素化反応12)が,経済的かつ環境低負荷な直接合成法として注目されている。従来の合成法では高価な有機金属試薬を原料とするだけでなく,目的物と等量以上の廃棄物を副生するに対し,この新手法では,安価な芳香族化合物を原料として用いることができ,副生成物として水素が発生するのみである。特に,イリジウム,ビピリジン,ビス(ピナコラート)ジボロン(B2pin2, pin=O2C2Me4)もしくはピナコールボラン(HBpin)から調製されるイリジウム錯体は,極めて高い触媒活性と幅広い基質適用性を示す優れた均一系触媒の一つである13)。しかし,この均一系触媒の回収と再利用は困難であり,耐久性が低いため,繰り返し使用することができない。
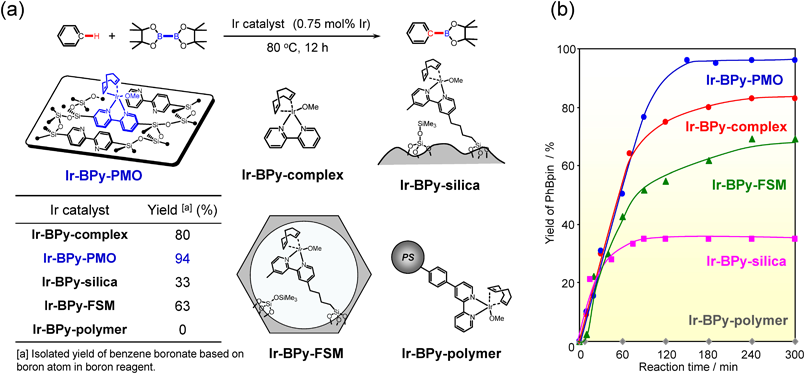
イリジウム錯体を固定化したBPy-PMO(Ir-BPy-PMO)は,イリジウム前駆体([Ir(OMe)(cod)]2)をBPy-PMOのビピリジン基に選択的に反応させることで合成した。得られた錯体の金属中心の局所構造ならびに電子状態は,XAFSならびにXPS測定により実施し,対応する均一系イリジウム錯体と高い類似性を確認できた。また,従来の固定担体であるシリカゲル,メソポーラスシリカ,ポリスチレンに固定化したイリジウム錯体の触媒評価も実施した(Fig. 6)。
Fig. 6aに,BPy-PMOと従来の固定担体に固定化したイリジウム触媒を用いたベンゼンのC–Hホウ素化反応の結果を示した。なお,すべての反応は,等しいイリジウム触媒量の存在下で実施した。Ir-BPy-PMOは,ベンゼンを高収率(94%)で目的物のボロン酸エステルに変換し,均一系触媒の収率(80%)を上回った。一方,メソポーラスシリカ,シリカゲルに固体化したイリジウム触媒を用いた場合,反応収率が63%と33%に留まった。すなわち,BPy-PMO表面に固定化したイリジウム触媒が,特異的に高い反応活性を示すことがわかった。シリカ表面にリンカーを用いてグラフトした触媒の場合,活性サイト近傍の理想的な触媒環境が大きく損なわれていると考えられる。
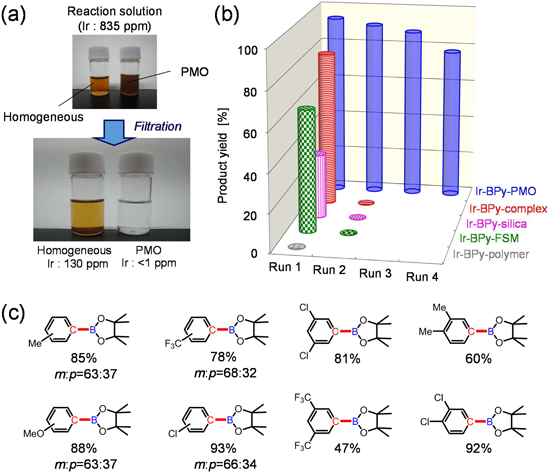
本反応の経時変化を調べたところ,均一系では,途中で活性が低下したのに対し,PMO系では,ほぼ量論的に反応が進行していることがわかった。これは,均一系ではイリジウム錯体の凝集が起こったのに対し,PMO系では細孔表面のアンカー効果により凝集が抑制されたためと解釈できる。もう一つ注目すべき点として,反応初期(60 min以内)の活性が,均一系触媒とほぼ同じであることがわかった(Fig. 6b)。これは,均一系触媒の活性がPMO表面への固定後も全く低下していないこと,そして,細孔内での基質拡散の影響がほとんどないことを示す。これは,PMOの細孔表面の均一構造と,比較的大きな細孔構造(3.8 nm)に起因しており,従来の固定担体にはないPMOの特長が活かされた結果と考える。更に,PMO触媒は,反応後,ろ過操作により容易に回収できた(Fig. 7a)。黒茶色のPMO触媒を含む反応液をろ過すると無色透明溶液になった。溶液中のイリジウムの濃度は1 ppm以下となっており,生成物への金属の混入を最小限に抑えることができる。一方,均一系触媒の場合,触媒の回収が困難であり,ろ過後の溶液にも触媒に由来する黄色の着色が観察された。また,回収したPMO触媒は,C–Hホウ素化反応に対して繰り返し利用が可能なことを確認した(Fig. 7b)。一方,均一系触媒と他の固定担体に固定したイリジウム触媒については,2回目以降は活性を示さなかった。これらの結果は,BPy-PMOが,均一系金属錯体触媒の固定担体として大きな可能性を有することを示している。
本触媒の基質適用性を調べたところ,電子供与性や求引性の置換基を有したベンゼン誘導体でもC–Hホウ素化が進行することがわかった(Fig. 7c)。反応の傾向として,電子求引性基を導入した基質が,良好な収率で目的物を与えた。また,一置換ベンゼンの場合,ボロン酸エステルが位置異性体(オルト体,メタ体)の混合物として得られたが,二置換ベンゼンの場合,単一の位置異性体が得られた。これは,置換基の立体反発の影響が少ないC–H結合がホウ素化されるためであり,均一系触媒でも同様の傾向が観察されている12)。
2,2′-ビピリジンを骨格導入した結晶状BPy-PMOの合成と,その細孔表面での金属錯体形成能,さらには金属錯体触媒の固定配位子として利用例を紹介した。イリジウム錯体を固定化したPMO触媒は,ベンゼンのC-Hホウ素化反応に対して均一系触媒と同等の触媒活性を示すだけでなく,回収・再利用性を示した。これらの技術は,医薬品合成のプロセスのグリーン化に大きく貢献できると考えられる。
BPy-PMOへの固定化による金属錯体の活性保持と耐久性向上は,他のビピリジン系金属錯体でも確認できており,BPy-PMOの優れた担体効果は一般的に適応可能と考えられる。PMOの利用により,これまで均一系を中心に発展してきた金属錯体のケミストリーを固体系へと大きく発展できると考えている。
引用文献References
1) A. Behr, P. Neubert. Applied Homogeneous Catalysis, Wiley-VCH, Weinheim, 688 (2012).
2) J. Huang, F. Zhu, W. He, F. Zhang, W. Wang, H. Li, J. Am. Chem. Soc., 132, 1492 (2010); R. Raja, J. M. Thomas, M. D. Jones, B. F. G. Johnson, D. E. W. Vaughan, J. Am. Chem. Soc., 125, 14982 (2003); I. Karamé, M. Boualleg, J.-M. Camus, T. K. Maishal, J. Alauzun, J.-M. Basset, C. Copéret, R. J. P. Corriu, E. Jeanneau, A. Mehdi, C. Reyé, L. Veyre, C. Thieuleux, Chem.-Eur. J., 15, 11820 (2009).
3) C. Li, Catal. Rev., 46, 419 (2004); T. Maschmeyer, F. Rey, G. Sankar, J. M. Thomas, Nature, 378, 159 (1995); H. Li, H. Yin, F. Zhang, H. Li, Y. Huo, Y. Lu, Environ. Sci. Technol., 43, 188 (2009).
4) S. Inagaki, S. Guan, Y. Fukushima, T. Ohsuna, O. Terasaki, J. Am. Chem. Soc., 121, 9611 (1999); T. Asefa, M. J. MacLachlan, N. Coombs, G. A. Ozin, Nature, 402, 867 (1999); B. J. Melde, B. T. Holland, C. F. Blanford, A. Stein, Chem. Mater., 11, 3302 (1999).
5) For selected reviews on synthesis and application of PMOs, see: N. Mizoshita, T. Tani, S. Inagaki, Chem. Soc. Rev., 40, 789 (2011); F. Hoffmann, M. Fröba, Chem. Soc. Rev., 40, 608 (2011); P. Van Der. Voort, M. D. Esquivel Merino, E. De Canck, F. Goethals, I. Van Driessche, F. J. Romero-Salguero, Chem. Soc. Rev., 42, 3913 (2013).
6) M. Waki, N. Mizoshita, T. Tani, S. Inagaki, Angew. Chem. Int. Ed., 50, 11667 (2011).
7) M. Waki, Y. Maegawa, K. Hara, Y. Goto, S. Shirai, Y. Yamada, N. Mizoshita, T. Tani, W.-J. Chun, S. Muratsugu, M. Tada, A. Fukuoka, S. Inagaki, J. Am. Chem. Soc., 136, 4003 (2014).
8) M. P. Kapoor, Q. Yang, S. Inagaki, J. Am. Chem. Soc., 124, 15176 (2002); N. Mizoshita, Y. Goto, M. P. Kapoor, T. Shimada, T. Tani, S. Inagaki, Chem.-Eur. J., 15, 219 (2009); A. Sayari, W. Wang, J. Am. Chem. Soc., 127, 12194 (2005); M. Cornelius, F. Hoffmann, M. Fröba, Chem. Mater., 17, 6674 (2005).
9) S. Bracco, A. Comotti, P. Valsesia, B. F. Chmelka, P. Sozzania, Chem. Commun., 4798 (2008); (b) A. Comotti, S. Bracco, P. Valsesia, M. Beretta, P. Sozzani, Angew. Chem., Int. Ed., 49, 1760 (2010).
10) D. G. Hall, Boronic Acids: Preparation and Applications in Organic Synthesis and Medicine Wiley-VCH Verlag GmbH & Co. KGaA, pp. 1 (2005).
11) N. Miyaura, A. Suzuki, Chem. Rev., 95, 2457 (1995).
12) T. Ishiyama, J. Takagi, K. Ishida, N. Miyaura, N. R. Anastasi, J. F. Hartwig, J. Am. Chem. Soc., 124, 390 (2002); T. Ishiyama, J. Takagi, J. F. Hartwig, N. Miyaura, Angew. Chem., Int. Ed., 41, 3056 (2002); T. Ishiyama, N. Miyaura, Pure Appl. Chem., 78, 1369 (2006).