生体内で様々な役割をする酵素は,エネルギー消費が少なく副生成物(廃棄物)も少ない,環境と調和した低環境負荷型の産業システムを実現する技術として注目されている。
その酵素のもつ極めて高い選択性や低濃度での反応性を利用し,環境中や生体試料中から得られた多成分の試料から特定成分を高精度に定量する方法として,酵素を利用したセンサーの研究が進められている。これらは電極と酵素固定層から構成され,試料中の被測定物質と酵素の反応により生じる物質の変化を,電位や電流の変化量として電気化学的に検出するものである。医療分野における酵素センサーの代表例はグルコース酸化酵素およびグルコース脱水素酵素を用いた血液自己管理用のグルコースセンサーである1,2)。このセンサーは市場において広く浸透しており,市場に受け入れられた理由として,簡便性と定量性を兼ね備えた点であると考えられる。ポスト・グルコースセンサーとしては,その場測定(POCT; Point of Care Testing)の研究・開発が進んでいる。POCT開発においては,マイクロ流路をベースしたセンサーヘッド(分離・反応・測定)をマイクロチップ化する開発が進められている3)。しかし,ヘッドを小型化するだけではPOCT用としては十分ではなく,測定システム,送液システムも小型にする必要性があり,実用化にはマイクロ化が重要なカギとなる。またGFP(Green Fluorescent Protein)などの蛍光タンパク質を用いたプローブ研究においては,遺伝子工学により,特定のタンパク質に結合したものを細胞内で生産することができ,FRET(Fluorescence Resonance Energy Transfer)4,5)やBRET(Bioluminescence Resonance Energy Transfer)6,7)を利用し,細胞や組織などの化学物資の濃度を簡便に選択的に測定することが可能である。しかし,このようなプローブを用いる系は,非接触,リアルタイムの測定が可能であるが,定量性としては必ずしも十分ではなく,生体に導入する場合の影響についても考慮する必要がある。このように,医療分野においては,センサーの重要性は感度および定量性であり,センサーの寿命や安定性に関しては必ずしも重要とはされていない。しかし,様々な分野で酵素センサーを使用する場合にはコスト面を考えるとやはり寿命や安定性が重要な要素になってくる。その理由として酵素は外部環境の変化で活性や選択性が低下することが多く,非酵素型のセンサーに比べ安定性に欠けて寿命が短くなりやすく,医療分野以外では実用化の上で大きな障害となっているからである。このため酵素の性能を損なわずに高い安定性を実現できる酵素の固定化方法の開発が望まれている。
私たちは,以前からシリカを材料とした直径2–10 nm程度の均一で規則的なメソ細孔を有する多孔体の構造精密制御技術に注目し8–10),その開発に取り組んできた。また,メソポーラスシリカの細孔サイズはタンパク質やDNAなどの巨大生体分子と同等の大きさであり,均一で規則的であるという特徴をもつため,酵素を細孔内へ固定化して安定化する研究をすすめ,有機溶媒中での酵素の反応性や熱安定性の大幅な向上などを実証してきた11–15)。一方,従来より環境中の有害物質検出用センサーの研究開発を行ってきた(株)船井電機新応用技術研究所は,このメソポーラスシリカ多孔体による酵素安定化技術に着目し,小型・高性能なセンサーデバイスの実現を目指し,高感度で高速測定可能な,高い安定性を有する酵素センサーおよびセンシング技術に関する共同研究を開始するに至った。その中で特に,シックハウス症候群を引き起こす原因物質として生体への影響が危惧されているホルムアルデヒド,および,中国などにおける加工食品・野菜などで近年問題が多発している残留農薬に注目し,ホルムアルデヒドおよび農薬検出用の酵素センサー計測システムについての研究開発を行ったので,その成果を紹介する。これらの技術は,我々の生活や健康を脅かす環境中の極微量物質を素早く高感度で検出する,「生活環境センシング技術」開発の一環としても重要な意味をもつ。
2.1 酵素センサー計測システムの開発
2.1.1 酵素複合膜の作製16,17)
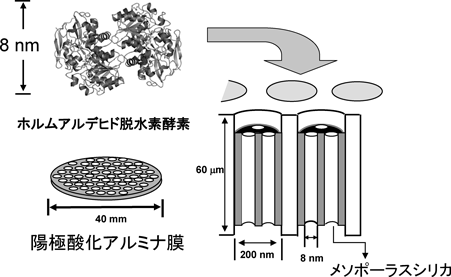
ホルムアルデヒドを選択的に検出するセンサーを構築するため,酵素としてホルムアルデヒド脱水素酵素を用いた。酵素センサーの高い安定性を実現させるため,酵素の分子サイズ(8 nm程度)に合致した細孔径を有するメソポーラスシリカ膜を構成し,その膜に酵素を固定した酵素複合膜の作製を検討した。
酵素固定化用の膜には,①細孔が規則正しく配列していること,②細孔径を精密に制御できること,③基質および反応生成物が効率良く移動できるよう,メソ細孔が基板と垂直に配向していること,が求められる。しかし,現在合成されているメソポーラスシリカ膜の多くは①および②は満たすものの,メソ細孔が基板と平行に配向しているために薄膜内の細孔に対する物質の拡散性が悪く,③を満足しない。この問題を解決するため,筆者らは東北大学と共同で,多孔性の陽極酸化アルミナ膜のもつ円柱状の細孔内にアルミナ膜表面に対して垂直配向(アルミナ膜の細孔に対して平行)したメソ細孔を有するメソポーラスシリカ膜の合成に成功した。さらにメソ細孔内にホルムアルデヒド脱水素酵素を導入することで酵素複合膜を構築した(図1)。
2.1.2 水溶液中での酵素センサーの性能18,19)
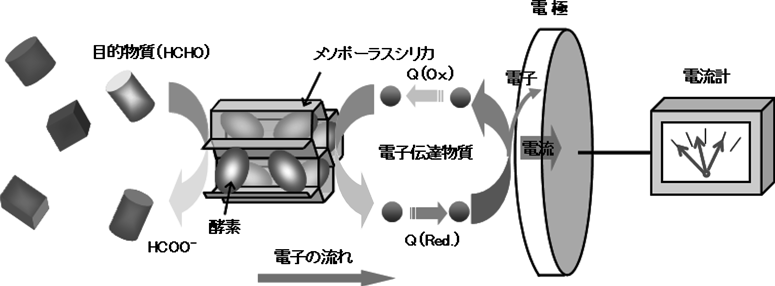
続いて2.1で作製した酵素複合膜に電極と電子伝達物質を組み合わせ,新しい酵素センサー計測システムを開発した。すなわち酵素膜を作用電極上に固定化し,適切な電子伝達物質によって固定化酵素と電極間の電子授受を媒介させる仕組みにより,ホルムアルデヒドに対し高い感度・選択的検出能力と応答速度を示すシステムを得ることができた(図2)。
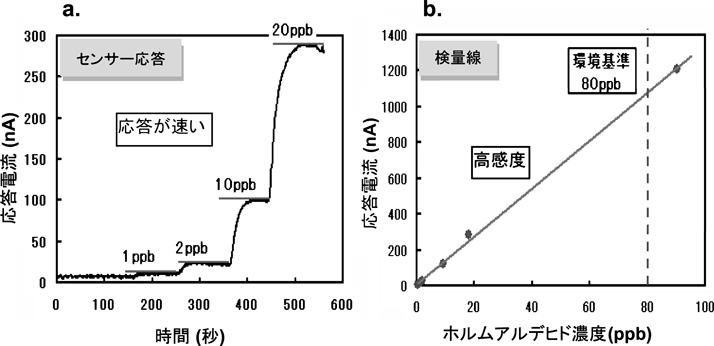
この酵素センサーによる水中のホルムアルデヒド(25°C)検出の評価結果を図3に示す。時間に対するセンサー応答(図3a)から,応答速度が1分以内(90%応答)と高速であり,また検量線(図3b)からわかるように,環境基準である80 ppbを遥かに下回る濃度領域(サブppb領域(10−11))でもホルムアルデヒド濃度に比例した出力が得られ,ホルムアルデヒドを超高感度で検出できている。この結果は,メソポーラス膜に固定化することで酵素の有する能力が最大限に引き出されたことによると考えられる。
2.1.3 酵素センサーの安定性
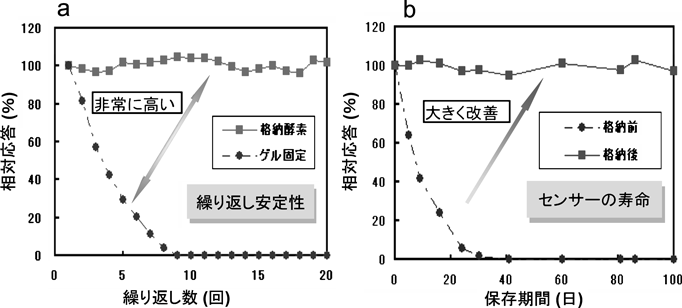
酵素センサーの安定性評価のため,繰り返し測定および保存期間に対するセンサー応答変化について測定した(図4)。繰り返し安定性では,本センサーで同様の測定を20回以上繰り返し行っても安定な出力を維持することが確認された。一方,アガロースゲルに包括固定化した酵素(ゲルの網目の中に酵素を絡ませて閉じ込めたもの)を使用した場合は,10回の繰り返しで応答がなくなった(図4a)。また溶液中での保存安定性に関しては,未固定の遊離酵素の場合は30日程度で応答が消失するのに対し,本酵素複合膜を使用した場合では100日以上も安定した出力が維持され,飛躍的な安定性の向上が確認できた。また,センサーの選択性も非常に高く,ホルムアルデヒドだけを選択的に検出することもわかった。
以上より,本酵素センサーが,水中に存在するホルムアルデヒドに対して高い選択的検出能力をもち,高速・高感度で長寿命な性能を有することが示された。
これらの性能は,
1) メソポーラスシリカ多孔体の細孔径を酵素サイズと合致するように制御し,酵素を細孔内部へ固定化することにより,酵素同士の凝集を抑えるとともに立体構造の安定性を高め,酵素活性の低下を防ぐ。
2) 適切な電子伝達物質(キノン)を用いて酵素と電極間の電子の授受を行うことにより,感度と応答速度を向上させる。
の2つのコンセプトにより実現したと考えられる。
2.3 ホルムアルデヒドガスセンサーへの応用
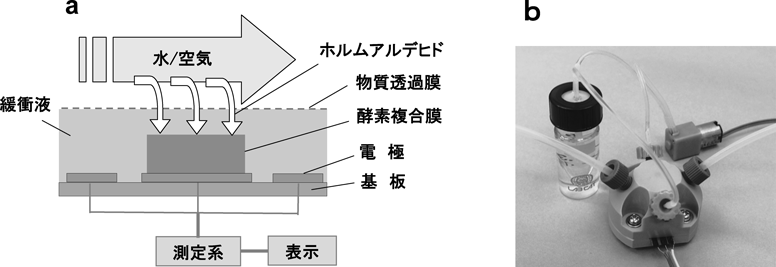
次に,この酵素センサーにより大気中ホルムアルデヒドを検出する実験を行い,ガスセンサーとしての性能を評価した。酵素センサーの構造および測定システムを図5aに,開発したプロトタイプのガスセンサーの外観を図5bに示す。本酵素センサーは,電極上に酵素固定化膜を形成し,そこに緩衝液を物質透過膜で閉じ込めた構造となっており,大気中のホルムアルデヒドは物質透過膜を介して溶液中に溶け込み,電極で直接検出される。
センサーには,緩衝液の液溜とポンプ,試料の入出力口などが設けてあり,大きさは約4 cm×4 cm×3 cm程度である。またセンサー評価のためのホルムアルデヒドガスは,独自に開発した極低濃度ガス発生装置により生成し,センサー部へ供給した。ガス発生方法の流れは,以下の通りである。ホルムアルデヒド標準ガスを高純度空気と混合・希釈することで極低濃度ガスを発生させる。そして,DNPH捕集管により試料ガスをサンプリングして抽出後,HPLC分析によりこのガス濃度を算出・保証する(DNPH-HPLC法)。目的とする濃度に合わせて混合比を変化させ,所定のガス濃度が得られるまでその操作を繰り返す。ただし,試料ガスのサンプリングと濃度決定には熟練および長い測定時間を要することに注意する。
このガス発生装置を用いて低濃度のホルムアルデヒドガスを生成し,開発したプロトタイプを用いてガス中のホルムアルデヒドガスの検出を行った。濃度10 ppbのホルムアルデヒドガスを導入した場合,ガス導入直後に十分な応答を示した。実際に,サブppbレベルのホルムアルデヒドガスを2分以内で検出することに成功した。現在は,さらに感度を向上させる技術的な目途もついており,犬の鼻に匹敵する高感度が期待できる。
これらの性能は,2.3に示したコンセプトの1),2)に加え,
3) 電極を含むセンサー構造を最適化し,ガスに対する感度・応答速度,測定の再現性を大幅に向上させた。
4) 緩衝液を循環する方式により,出力信号を測定後に素早く基準値に戻し,繰り返し測定を迅速化することに成功した。
ことにより達成されたものである。なお,本酵素センサーは,電極材料および電子伝達体の改良などにより,低い印加電圧(+30 mV)で動作している。
3.1 高性能計測技術の開発
3.1.1 酵素複合膜の作製20)
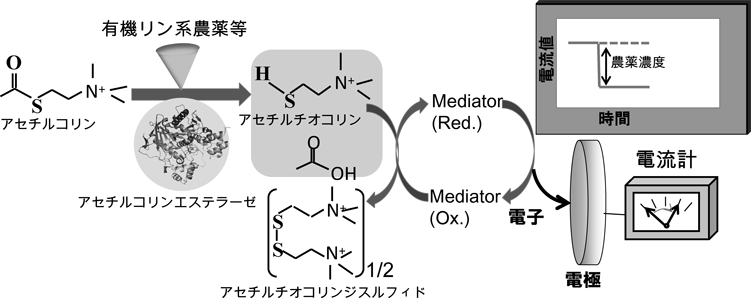
ホルムアルデヒドセンサーの開発を基に農薬センサーの開発を行った。本開発では,有機リン系およびカーバメート系農薬を検出するため,酵素(アセチルコリンエステラーゼ)の活性阻害反応を利用した。すなわち,図6に示す一連の酵素反応において,試料中に有機リン系およびカーバメート系の農薬が存在すると,コリンエステラーゼの酵素活性が低下し,電極上で計測される電流値が低下する。この電流値低下から,試料中の農薬濃度を決定する。
農薬の検出の場合,ホルムアルデヒドとは違い,検出対象物が大きいため,酵素固定化担体が検出対象物質の拡散を阻害することによる反応効率の低下などが起こり,センサーの感度・応答速度・精度などが著しく劣化してしまうことが予想される。我々は,酵素本来の優れた特性を十分に引き出すため,酵素を“はめ込む”サイトと検出対象物が通るサイトを分離した無数の規則的な微細孔を有し,物質拡散制限がない高次ナノ構造をもつ薄膜状の構造体の合成を行った。具体的な方法としては,シリカと界面活性剤を混合した前駆溶液を,所定の細孔径をもつ陽極酸化ポーラスアルミナ膜の微細孔に流し込み,乾燥・焼成することで高次ナノ構造体を作製した。この際,界面活性剤のアルキル基鎖長,拡張剤の添加,前駆溶液調整条件等の制御により,界面活性剤にF127({(EO)100(PO)65( EO)100}),前駆体の攪拌時間15時間,温度60度で目的とする構造の高次ナノ構造体を作製した(図7a)。得られた構造は走査電子顕微鏡(SEM)・透過電子顕微鏡(TEM)観察,窒素吸着測定およびX線回折により,微細管の径,微細孔径,均一性,規則性を評価した。
電子顕微鏡による測定は,高次構造体のアルミナ部分を10%リン酸水溶液によりエッチングし,円柱状メソポーラスシリカを捕集した後に行った。図7b-i)に示すように陽極酸化アルミナ細孔壁面にチューブ状の高次ナノ構造体が形成していることが確認できる。また,アルミナ部分をリン酸でエッチングすることにより,アルミナ細孔内に形成された直径約200 nm,内径約100 nmのシリカチューブが観察された(図7b-ii)),その表面のSEMおよびSTEM観察により,規則的な13〜14 nm程度の細孔が基板から内側に向けて開いていることを確認した(図7b-iii), b-iv))。また,シリカチューブ内のSEM観察でも規則的な細孔が観察できた(図7b-iv)。さらに窒素吸着からも約14 nmの規則的な細孔(BJH法)をもつ構造であることが確認され,STEM像での細孔径の値と一致した。この微細孔内に酵素を固定化すれば,酵素の凝集を抑えて高密度集積するとともに構造安定性を高めて失活を防ぎ,酵素の触媒能力と安定性を飛躍的に向上させることができると考えられる。
3.1.2 酵素固定化プロセスの確立21)
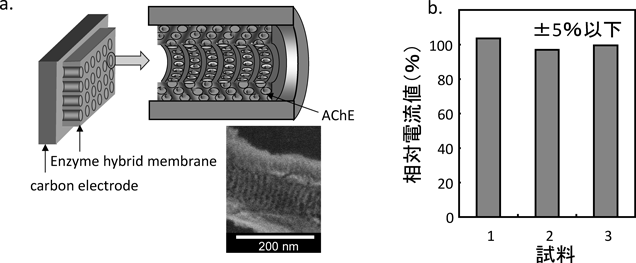
高次ナノ構造体の微細孔内にアセチルコリンエステラーゼ(AChE)を固定化し,高密度で効率的な固定化技術の開発を実施した(図8a)。実験方法は高次構造体膜(100 mg)を5 mlの酵素溶液(0〜3 mg/l)に入れ,15時間,4度で撹拌した。吸着量の測定は吸着前後の上澄みの酵素濃度変化から計出した。タンパク質の濃度はBCA法を用いて決定した。その結果,酵素の吸着量はタンパク濃度に応じて担体への吸着量が増加し,吸着量は0.38 wt%程度で飽和することを確認した。また,吸着酵素は担体から流出しないこと,酵素が安定に固定化されていることを確認した。
次に,固定化した酵素の反応性のバラツキについて別々に調整した酵素複合膜を用い,その活性に伴う電極反応性を評価した。図8aの模式図のように電極に酵素膜を固定し,電流応答を測定した。なお,作用極はグラッシカーボン電極(GC),電子伝達物質としてテトラシアノキノジメタン,基質はアセチルチオコリンを用いた。測定結果を図8bに示す。縦軸は相対電流値,横軸は各々同じ方法で作製した酵素複合膜を示している。個別に作製した酵素複合膜を使用した場合でも,電極の応答性のバラツキは±5%以下であることが確認できた。
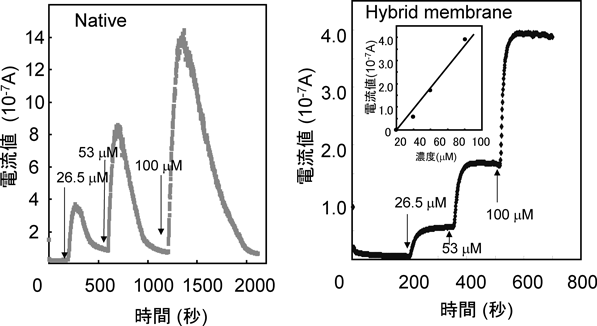
図9に遊離酵素および固定化酵素の場合の応答の比較例を示す。遊離酵素の場合,基質であるアセチルチオコリンを一定量反応溶液内に導入すると,時間とともに電流値が上昇し,ピークを示した後に急速に低下し,電流値の安定は見られなかった。このときのピーク電流値は,ほぼアセチルチオコリン濃度に比例する。一方,高次ナノ構造体に固定化した酵素の場合,遊離酵素に比べ最大電流値は約1/3に低下しているが,基質添加後の電流値は一定である(図9b)。また,この定常電流値は,アセチルチオコリン濃度に比例している。開発する農薬センサーでは,図6に示すように,一定のアセチルチオコリンの存在下で農薬成分により電流が低下する状況の検出を想定しているため,酵素固定化高次ナノ構造体を酵素電極に使用することにより,遊離酵素を使用する場合と比較してより安定な測定が可能になると考えられる。
3.1.3 酵素センサーの安定性
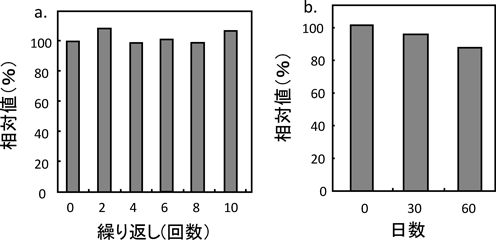
図10に酵素固定化高次ナノ構造体の繰り返し安定性(a)と保存安定性(b)について示す。図10aでは縦軸が相対値,横軸に繰り返し回数を示している。酵素固定化高次ナノ構造体は,10回繰り返し使用しても相対値の低下が見られなかった。これはタンパク質が安定に固定化され,繰り返しによって酵素活性が低下しないことを示している。図10bは保存安定性の実験結果を示す。縦軸は相対値,横軸は日数を示している。酵素固高次化ナノ構造体は60日たっても80%以上の活性を維持していることがわかる。以上の結果から開発した酵素固定化高次ナノ構造体を用いた電極は,遊離酵素と比較して安定な測定が可能であることが確認され,繰り返し安定性,および,保存安定性が高いことが示された。
3.2 プロトタイプ農薬センサーの開発22)
酵素固定化高次ナノ構造体をスクリーン印刷により作製した電極上に固定化し,さらに,農薬検出・結果表示のためのセンサヘッドおよび周辺回路技術も設計・製作し,残留農薬センサーのプロトタイプを開発した。なお,今回開発した試作品の検出部への試料の導入には簡便で安価なディスペンス方式を採用し,電極を含む検出部の大きさは10 cm×10 cm×10 cm以内を実現した(図11)。
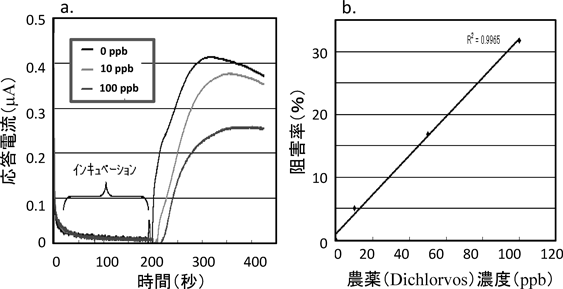
開発したプロトタイプを用いて,数種類の有機リン系およびカーバメート系農薬に対する農薬検出実験を行った。図12にジクロルボス(Dichlorvo,有機りん系農薬)検出に対する応答電流測定の例(a),および,検量線(b)を示す。
図12aより,基質であるアセチルチオコリンを添加すると急激に電流値が上昇し,ほぼ一定の電流値に到達することがわかる。また,添加するメタミドホス濃度の増加に伴い,電流値の低下が観測される。これは,固定高次ナノ構造体に固定化された酵素がメタミドホスによって阻害され,応答電流値低下を引き起こしたためと考えられる。阻害率I(%)は,応答後の電流値iを用いて,
で表される。ただし,i0はジクロルボス無添加時の応答電流である。この式を用いて実際に検量線の算出を行い(図12b),複数の有機リン系およびカーバメート系農薬に対して,農薬濃度10 ppbが5分程度で検出できることが確認できた。
3.3 各種センシングへの応用
上述のように,本酵素センサーは,酵素の選択とメソポーラスシリカ多孔体の最適化により,他の様々な種類の物質の検出にも応用することが可能である。実際に,飲酒量のチェックとなるアルコール,口臭指標となるアンモニアなどのガスセンシングへと応用し,これらの極低濃度ガスの検出にも成功している。さらに,我々の生活や健康を脅かす環境中の極微量濃度の有害物質の高速・高感度検出についても現在取り組んでいるところである。
メソポーラスシリカ膜のメソ細孔に酵素を固定化することにより,高性能・長寿命な酵素センサーの開発に成功した。これは従来の酵素センサーの課題であった不安定性を克服し,小型で高性能なセンサーの実用化へ大きく前進したものといえ,高感度・高選択性が求められる検出方法として本センサーおよびセンシング技術が有望であると考えられる。今後,大掛かりな装置を必要としない小型で高性能なセンシングデバイスの実現,また,それによる安全・安心・快適な暮らし,社会の実現へ向けて大きく貢献することが期待できる。またセンシングデバイスのみならず,本酵素安定化技術を用い,より耐環境性を向上させた超高速・高選択性を有する環境に優しい触媒と,それによる機能性化学品の製造プロセスの実現も目指していきたいと考えている。
謝辞Acknowledgments
酵素複合膜作製において研究協力していただいた茨城大学理学部,山口央准教授,東北大学大学院理学研究科,寺前紀夫教授に感謝いたします。本研究の一部は独立行政法人科学技術振興機構(JST)で行われたものであり,ここに謝意を表します。
引用文献References
1) S. Tsujimura, S. kojima, K. Kono, T Ikeda, M. Sato, H. Sanada and H. Omura, Biosci. Biotechnol. Biochem., 70, 654 (2006).
2) H. Yamaoka and K. Sode, Diabet. Sci. Technol., 1, 28 (2007).
3) T. G. Henares, F. Mizutani, H. Hisamoto, Anal. Chim. Acta, 611, 17 (2008)
4) Selvin, P. R.(1995)Methods in Enzymology: Fluorescence resonance energy-transfer, Volume 246, pp. 300-334, Academic Press, San Diego.
5) Ha, T., Enderle, T., Ogletree, D. F., Chemla, D. S., Selvin, P. R., and Weiss, S.. Proc. Natl. Acad. Sci. U.S.A., 93, 6264 (1996).
6) H. Hoshino, Y. Nakajima and Y. Ohmiya, Nat. Methods, 4, 637 (2007).
7) S. B. Kim, T. Ozawa, S. Watanabe and Y. Umezawa, Proc. Natl. Acad. Sci. U.S.A. 101, 11542 (2004).
8) T. Yanagisawa, T. Shimizu, K. Kuroda and C. Kato, Bull. Chem. Soc. Jpn., 63, 988 (1990).
9) C. T. Kresge, M. E. Leonowicz, W. J. Roth, J. C. Vartuli and J. S. Beck, Nature, 395, 710 (1992).
10) S. Inagaki, Y. Fukushima, K. Kuroda, J. Chem. Soc., Chem. Commun., 680 (1993).
11) T. Itoh, R. Ishii, T. Ebina, T. Hanaoka, Y. Fukushima, F. Mizukami: Bioconjugate Chem., 17, 236 (2006).
12) T. Itoh, R. Ishii, T. Ebina, T. Hanaoka, T. Ikeda, Y. Urabe, Y. Fukushima, F.Mizukami: Biotechnol. Bioeng., 97, 200 (2007).
13) Y. Urabe, T. Shiomi, T. Itoh, A. Kawai, T. Tsunoda, F. Mizukami, K. Sakaguchi, ChemBioChem, 8, 668 (2007).
14) S. Matsuura, T. Itoh, R. Ishii, K. Sakaguchi, T Tsunoda, T. Hanaoka, F. Mizukami, Bioconjugate Chem., 19, 10 (2008).
15) T. Itoh, R. Ishii, S. Matsuura, S. Hamakawa, T. Hanaoka, T. Tsunoda, J. Mizuguchi, F. Mizukami: Biochem. Eng. J., 44, 167 (2009).
16) A. Yamaguchi, H. Kaneda,W. Fu, N. Teramae: Adv. Mater., 20, 1034 (2008).
17) T. Itoh, R. Ishii, Y. Hasegawa, J. Mizuguchi, T. Shiomi, T. Hanaoka, T. Shimomura, A. Yamaguchi, H. Kaneda, N. Teramae, F. Mizukami: J. Mol. Catal. B-Enzym., 57, 183 (2009).
18) T. Shimomura, T. Itoh, T. Sumiya, F.Mizukami,M. Ono: Sens. Actuator B-Chem, 135, 268 (2008).
19) T. Shimomura, T. Itoh, T. Sumiya, F.Mizukami,M. Ono: Talanta, 78, 207 (2009).
20) T. Itoh, T. Shimomura, Y. Hasegawa, J. Mizuguchi, T. Hanaoka, A. Hayashi, A. Yamaguchi, N. Teramae, M. Ono and F. Mizukami: J. Mater. Chem., 21, 251 (2011).
21) T. Itoh, T. Shimomura, T. Sumiya, M. Ono and T. Hanaoka, 2nd International Conference on Bio-Sensing Technology 2011, 44 (2011).
22) T. Shimomura, T. Itoh, T. Sumiya, F.Mizukami,M. Ono: Enzyme and Microbial Tech., 45, 443 (2009).